“绿色化学”又称环境无害化学、环境友好化学、清洁化学,某化学课外小组利用废铜制取硫酸铜,设计了如下制取方案,其中符合“绿色化学”要求的是( )
A.Cu CuSO4 CuSO4 |
B.Cu CuSO4 CuSO4 |
C.Cu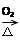 CuO CuO CuSO4 CuSO4 |
D.Cu Cu(NO3)2 Cu(NO3)2 Cu(OH)2 Cu(OH)2 CuSO4 CuSO4 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
6 |
0.2 |
5 |
0.2 |
9 |
| C |
35 |
8 |
0.15 |
10 |
0.1 |
2 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
在100 ℃时,将0.40 mol二氧化氮气体充入2 L密闭容器中,每隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
下列说法中正确的是
A.反应开始20 s内以二氧化氮表示的平均反应速率为0.001 25 mol·L-1·s-1
B.80 s时混合气体的颜色与60 s时相同,比40 s时的颜色深
C.80 s时向容器中加入0.32 mol氦气,同时将容器扩大为4 L,则平衡将不移动
D.若起始投料为0.20 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是
Ag(s)+Fe3+ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是
| A.升高温度 | B.加水稀释 | C.增大Fe2+的浓度 | D.常温下加压 |
已知图一表示的是可逆反应CO(g)+H2(g)  C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.若图一t2时改变的条件是增大压强,则反应的ΔH增大 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
对可逆反应A2(g)+B2(g)  2AB(g) 在一定条件下,达到平衡状态的标志是
2AB(g) 在一定条件下,达到平衡状态的标志是
| A.单位时间内生成2n mol AB的同时,生成n mol的B2 |
| B.平衡时容器内的总压强不随时间而变化 |
| C.平衡时容器内各物质的物质的量比为1∶1∶2 |
| D.单位时间内,生成n mol A2的同时,生成n mol的B2 |