用离子方程式表示下列反应
(1)Cl2通入NaHCO3水溶液中
(2)向Fe(NO3)2滴入几滴稀硫酸
(3)SO2通入高锰酸钾酸性溶液中
(4)向FeBr2通入等物质的量的Cl2
(5)向明矾溶液中滴入Ba(OH)2溶液,使得产生的沉淀质量最大
有A、B、C、D四种可溶性盐,其阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、Cl-、SO42-、CO32-中的某一种,每种离子只存在于一种物质中,不能重复出现。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,可见到A溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,则B溶液有白色沉淀产生,C溶液有无色无味气体产生。
根据以上实验可推知
①四种盐的化学式分别是:A,B,C,D。
②写出B溶液产生白色沉淀的离子方程式。
③写出C溶液有无色无味气体产生的离子方程式。
在烷烃分子中的基因:—CH3,—CH2—,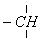
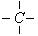 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4表示,例如:
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4表示,例如: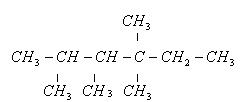
分子中n1="6" , n2="1" , n3="2" , n4=1试根据不同烷烃的组成和 结构,分析出烷烃(除甲烷外)中各原子数的关系。
结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数为no,no与n1、n2、n3、n4、的关系是:
n0=或n0=。
(2)四种碳原子数间的关系为。
(3)若某分子中n2=n3=n4= 1则该分子的结构简式可能是。
1则该分子的结构简式可能是。
人们应用原电池原理制作了多种电池,以满足不同的需要。在现代生活、生产和科学技术的发展中,电池发挥着越来越重 要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
(1)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
①工作时电流从 极流向 极(两空均选填“Ag2O”或“Zn”)。
②电极反应式为:正极,负极。
(2)(4分)蓄电池在放电时起原电池作用,在充电时起电解池的作用。爱迪生蓄电池分别在充电和放电时发生的反应 为:
为:
①放电时,正极为。正极的电极反应式为。
②该蓄电池中的电解质溶液应为(选填“酸性”或“碱性”)溶液。
某烷烃发生氯代反应,其一氯代物只有一种。7.2g该烃进行氯代反应完全转化为一氯代物时,放出的气体可使500mlL 0.2mol/L的烧碱溶液恰好完全中和。计算该烃的分子式并写出结构简式。
实验室常用浓硫酸和乙醇混合加
 热制取乙烯。
热制取乙烯。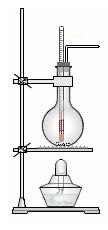
(1) 实验室制乙烯的化学方程式为。
(2)实验室用浓硫酸和乙醇混合加热制乙烯可用如上图所示装置,下列说法正确的是。
A.浓硫酸只作催化剂
B.在反应容器中放入几片碎瓷片防止混合液暴沸
C.反应温度缓慢上升至170℃
D.用排水法或向下排气法收集乙烯
E.园底烧瓶中装得是4mL乙醇和12mL3mol/L H2SO4混合液
F.温度计应 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度
G.反应完毕后先熄灭酒精灯,再从水中取出导管
(3)若将此装置中的温度计换成分液漏斗,则还可以制取的气体有(酒精灯 可用可不用)。
可用可不用)。
A.CO2B.NH3C.O2 D.SO2E.NO2F.Cl2
(4) 如温度过高,反应后溶液颜色变。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。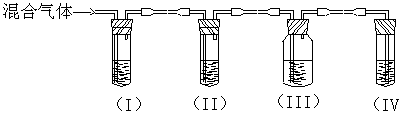
①I、II、III、IV装置可盛放的试剂是(请将下列有关试剂的序号填入空格内):
A、品红 B、NaOH溶液 C、浓硫酸D、酸性KMnO4溶液
I ;II;III;IV。
;II;III;IV。
②能说明SO2气体存在的现象是
③使用装置II的目的是;
④使用置III的目的是 ;
⑤确定含有乙烯的现象是。