月球含有、、、、、等元素,是人类未来的资源宝库。
(1)是高效核能原料,其原子核内中子数为。
(2)的原子结构示意图为,在氧气中完全燃烧所得产物的电子式为。
(3)在工业上应用广泛,可由制备。
①的熔点比的熔点(填"高"或"低")
②月球上某矿石经处理得到的中含有少量,除去的离子方程式为;的晶体类型为。
③与炭粉和氯气在一定条件下反应可制备。若尾气可用足量溶液完全吸收,则生成的盐为(写化学式)。
(4)月壤中含有丰富的,从月壤中提炼1同时可得6000和700,若以所得和为原料经一系列反应最多可制得碳酸氢铵kg。
有下列物质:氧气、浓硫酸、二氧化硫、硫化氢、铜片、钠、焦炭、氨气
请选择合适的物质填空,并回答有关问题:
(1)单质投入滴有酚酞的水中,有气体生成、溶液变红,请写出该反应的离子方程式:
(2)二氧化硫表现氧化性的实验,选择的试剂应是二氧化硫和
(3)能使酸性高锰酸钾溶液退色的酸性氧化物为
(4)两种物质间反应,生成的两种气体均能使澄清石灰水变浑浊,请写出该反应的化学方程式:
(5)发生催化氧化(制硝酸其中的一步)的化学方程式
人造羊毛的主要成分为CHCH2CN,此物质可由以下三种途径合成,已知A是石油分馏的一种产品.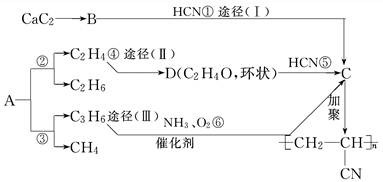
回答下列问题:
(1)写出A的分子式________,D的结构简式________.
(2)在反应①~⑥中,属于加成反应的是__________,属于裂化反应的是__________.
(3)写出反应⑥的化学方程式:____________________________________________
________________________________________________________________________.
(4)从能源环保的角度看,你认为最有发展前景的是________,其中理由是:
________________________________________________________.
酸牛奶是人们喜爱的一种营养饮料.酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖.酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用.工业上乳酸可由乙烯来合成,方法如下: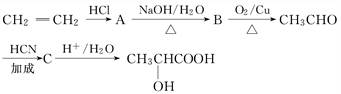
(1)乳酸所含的官能团的名称是_________________________________________.
(2)乳酸自身在不同条件下可形成不同的酯,其酯的相对分子质量由小到大的结构简式依次为:__________________、__________________、__________________.
(3)写出下列转化的化学方程式:
A的生成________________________________________________________.
CH3CHO的生成______________________________________________________,
C的生成____________________________________________________________.
A→B的反应类型为___________________________________________________.
医药化学杂志报道,用聚乙交酯纤维材料C制作的缝合线比天然高分子材料的肠衣线的性能好.它的合成过程如下:
(1)写出A的结构简式______________________________________________.
(2)写出A制取B的化学方程式_______________________________________.
(3)可以由A直接制备C,则由A直接制备C的化学方程式为_____________.其反应类型为________________.
高分子化合物A和B的部分结构如下: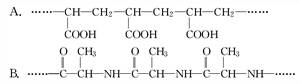
(1)合成高分子化合物A的单体是________,生成A的反应是________反应.
(2)合成高分子化合物B的单体是________,生成B的反应是________反应.