在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: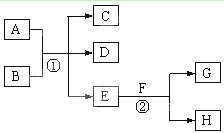
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊
试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,
反应①的离子方程式是 。
黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)滤渣Ⅰ的主要成分为 (填化学式);若通入足量的二氧化碳,滤液的主要溶质为 (填化学式)。
(2)“酸溶Ⅰ”时发生反应的离子方程式为 。
(3)“氧化”时,发生反应的离子方程式是 。“氧化”时应控制温度不超过57℃,其原因是 。
(4)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是 。
(本题10分)
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命。
已知:当反应条件为光照且与X2反应时,通常是X2与烷或苯环侧链烃基上的H原子发生的取代反应,而当反应条件为催化剂存在且与X2的反应时,通常为苯环上的H原子直接被取代。
下面是M5纤维的合成路线(部分反应未注明条件):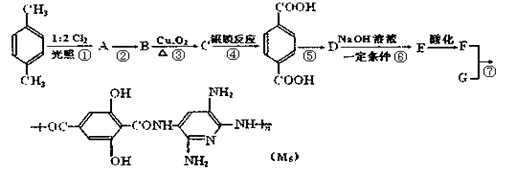
根据上述合成M5纤维的过程,回答下列问题:
(1).合成M5的单体的结构简式为______,;F的含氧官能团的名称有_____。
(2).在①~⑥的反应中,不属于取代反应的是______,反应②的条件是_______。
(3).生成A的同时可能生成的A的同分异构体为。
(4).1mol的C和足量新制的氢氧化铜悬浊液反应可以生成_________mol砖红色沉淀。
(5).1mol的F和Na2CO3溶液反应最多消耗Na2CO3mol。
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
…… |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
…… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
(本题12分)
磷是重要的非金属元素。磷单质及其化合物在工业生产中有着广泛的应用。
次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空
(1).磷原子的最外层电子排布的轨道表示式为 ______;氧原子核外电子云有 种不同的伸展方向,其最外层有 种不同运动状态的电子。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为。
(2).写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式。
(3).磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是__________________________________________________。(请用文字描述)
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。
(4).写出该反应的化学方程式__________________________。
(5).每消耗24.0g碳时,有mol电子发生转移。反应所得混合气体,折算成标况下,其气体密度为g/L。