为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I .打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1) 过程Ⅰ的目的是 。
(2) 棉花中浸润的溶液化学式为 。
(3) A中发生反应的化学方程式为 。
(4)过程Ⅳ中检验其中Fe3+和Fe2+的试剂分别为 和 。
确定有Fe3+和Fe2+现象分别是 和 。
(5) 过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6) 甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
⑴写出下列仪器的名称: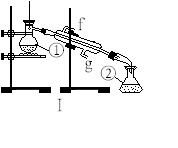
①____________;②____________;④____________;
⑵仪器①~④中,使用时必须检查是否漏水的有__________ 。(填序号)
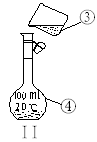
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有________________,将仪器补充完整后进行的实验操作的名称为;_________________ 。现需配制250 ml 0.2 mol/L NaCL溶液,装置II是某同学转移溶液的示意图,图中的错误是__________________
__________________________________________________________________(指出两处)。
欲除去硝酸钾固体中混有的少量氯化钾杂质,某学生进行如下实验操作。回答下列问题:
⑴溶解样品。该过程所需的仪器有_______________________________________________。
⑵向溶解后的溶液中加入适量的 ____________ (填化学式)溶液,使氯化钾转化为沉淀。
⑶将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:
① _____________________________________;
② _____________________________________。
下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)。
(2)倒入NaOH溶液的正确操作是(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 3 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
四氯化硅是粗硅精炼中的中间产物,熔点-70℃,沸点57.6℃,在潮湿空气中水解生成硅酸和氯化氢。某兴趣小组在实验室里通过下图所示装置制取少量四氯化硅: 
如何检验上图气体发生装置的气密性: ______________________
A装置中发生反应的离子方程式为: ________________________
A装置中玻璃实验仪器名称为(写出两种即可):_______和_______
B中的液体为:______________F中碱石灰的作用为:① __________②________
先加热图中哪个装置:__________________原因:________________________
若实验中用12mol·L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量
总是小于0.03mol,试分析可能存在的原因是:① __________② _________