下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
(1)A中发生的化学反应的离子方程式为 。
(2)C中盛装的药品__________;
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2与SO2等物质的量通入水中则无漂白作用,试写出化学方程式 。
(6)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①当有0.2mole-转移时被氧化的HCl的质量是 ;
②如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将 。
| A.≥1.68L | B.>1.68L | C.≤1.68L | D.<1.68L |
如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_________极, Cu极发生____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_____反应,电极反应为________。B 池中的总反应为_ __。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。
反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题: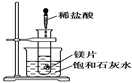
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。
(1)利用反应Ca(s)+O2 CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下: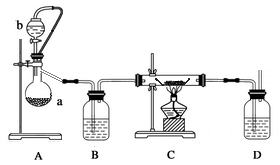
请回答下列问题:
①装置A中反应的化学方程式为____________;仪器a的名称为__________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是_______________。仪器安装后应进行的实验操作:
a.通入氧气
b.检查装置气密性
c.加入药品
d.停止通氧气
e.点燃酒精灯
f.熄灭酒精灯
g.冷却至室温,
正确的操作顺序为________。
②完全反应后,有关数据记录如下:
| 空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
| 14.80 |
15.08 |
15.25 |
据此可判断m2与理论值不符,则产物中的杂质可能是_________________________。
(2)利用反应Ca2++H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图如下: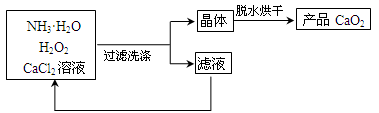
请回答下列问题:
①主反应中,NH3·H2O在Ca2+和H2O2的反应历程中所起的作用是_______________;该反应所需的条件及操作为_______(填字母)。
a.把氯化钙溶液逐滴加入过氧化氢—氨水溶液中
b.把过氧化氢—氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热 f.反应体系冰水浴冷却
洗涤CaO2·8H2O晶体时,判断晶体是否完全洗净的试剂为_____;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为_____。
②利用反应2CaO2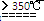 2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。
2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果______(填“偏大”、“偏小”或“无影响”)。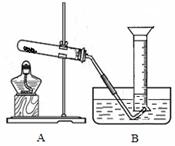
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
某同学设计如图所示装置(夹持装置已略去,量气管可上下移动)可分别进行下列实验探究
| 实验 |
药品 |
制取气体 |
量气管中液体 |
| Ⅰ |
铜片,浓HNO3(过量) |
NO2 |
CCl4 |
| Ⅱ |
NH3 |
煤油 |
|
| Ⅲ |
MnO2,HCl(浓) |
Cl2 |
|
| Ⅳ |
硅铁合金,NaOH溶液 |
H2 |
H2O |
请回答下列问题:
(1)实验前,某同学检查装置气密性的操作方法是:将活塞K关闭,再将量气管向上提高,其判断装置漏气或不漏气的现象分别是_____
(2)另一同学欲通过实验Ⅰ收集并测量NO2气体的体积来探究铜片的纯度,所测得的结果比真实值偏小(不考虑操作误差),你认为可能的原因是____。
(3)若进行实验II制NH3,则烧瓶和分液漏斗中应分别盛装适量的____。
(4)若进行实验III,该装置缺少的玻璃仪器是____;该反应的离子方程式是_________ 量气管中最好装的液体是_____(选填字母代号)。
a.NaOH溶液 b.水 c.饱和NaCl溶液 d.苯乙烯
(5)实验IV时,应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②_________,③读数时,视线与凹液面最低处水平相切。经多次重复实验,获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
某硅铁合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0 mL |
346.3mL |
| ② |
1.0g |
10.0mL |
336.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出硅铁合金中硅的质量分数为____。