如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题: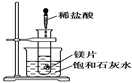
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料氯化钠时,设计了以下操作流程: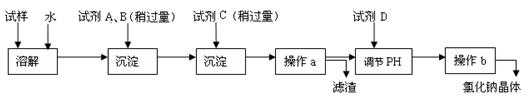
请回答以下问题:
(1)在所提供的试剂中选择:试剂C是
①Na2CO3②BaCl2③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、、三脚架和玻璃棒。
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接,接;B接,接。
(4)写出通入C后,烧杯中所发生的离子反应方程式
(5)电解氯化钠溶液时的离子方程式为
若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况)。将U形管内的溶液混合均匀,其pH约为_______ 。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
(6)若想准确读取所得氢气的体积,应采取的操作有
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。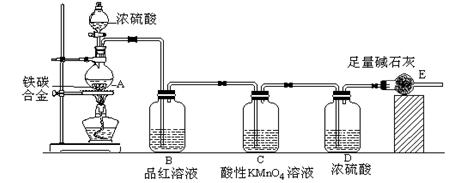
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。
⑶B中的现象是: ;C的作用是: 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
I向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象:
(1)罐壁内凹而瘪的原因:
反应方程式:
(2)罐壁重新鼓起的原因:
反应方程式:
II某学生课外活动小组利用如图所示装置分别做如下实验: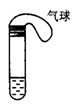
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________________________。
某化学小组采用装置(如图),以环己醇制备环己烯

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是______。
②试管C置于冰水浴中的目的是________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4c.Na2CO3溶液
H2SO4c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
(15分)下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气
(2)浓硫酸使木条变黑
(3)热的浓硫酸与铜片反应
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用(选填①10mL、②50mL 、③100mL)规格的量筒;