某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO•PbSO4•H2O),进行资源回收研究,设计实验流程如下:
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):
(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、
、洗涤、干燥,可获得Na2SO4•10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失)。
如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。图中B和C的水溶液反应生成F和G。
根据图示回答问题:
(1)写出E的化学式: E___,H的电子式H_____;
(2)反应①的离子方程式是_________________;
反应②的化学方程式是_____________________;
(3)J与盐酸反应的化学方程式是_______________;
反应后的溶液与D反应的离子方程式是___________________。
在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如下表所列:
| ① |
② |
③ |
④ |
⑤ |
|
| ① |
—— |
↑无色 |
↓白色 |
↓白色 |
无明显现象 |
| ② |
↑无色 |
—— |
无明显现象 |
↓淡黄色 |
无明显现象 |
| ③ |
↓白色 |
无明显现象 |
—— |
↓白色 |
无明显现象 |
| ④ |
↓白色 |
↓淡黄色 |
↓白色 |
—— |
↓黄色 |
| ⑤ |
无明显现象 |
无明显现象 |
无明显现象 |
↓黄色 |
—— |
| 结论 |
请在该表的“结论”中填写这些编号所代表的化学式
欲用实验方法证明KClO3中含有氯元素,可先取适量KClO3及少量于试管中,充分加热后,再溶于适量蒸馏水并过滤,最后取滤液少许,滴加溶液和,有白色沉淀生成,则说明KClO3中含Cl元素.写出有关反应的化学方程式:.
香豆素是一种用途广泛的香料,它可以利用乙醇和B通过以下途径合成,其中B的分子式为C7H6O2。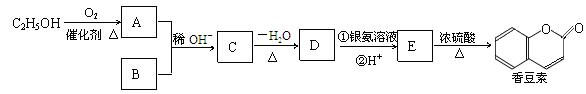
已知: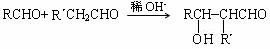 (R、R´为烃基)
(R、R´为烃基)
(1) A的名称为: ,C→D的反应类型为: ,C含有的官能团名称为: 。
(2)D的结构简式是 ;
(3)完成下列反应的化学方程式:
E在一定条件下发生加成聚合反应: ;
E→香豆素: ;
(4)B有多种同分异构体,其中苯环上只有一个侧链的所有同分异构体的结构简式是 ; (5)有关香豆素的说法正确的是 (填字母)。
a.只能与溴单质发生加成反应,不能发生取代反应
b.1 mol香豆素可与5 mol H2发生加成反应
c.1 mol香豆素可与2 mol NaOH发生反应
d.1 mol香豆素完全燃烧消耗9.5mol O2
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是。
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(3)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(4)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mL KMnO4溶液(硫酸酸化)恰好完全反应。写出反应的离子方程式。