(9分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N(C4H8O2)。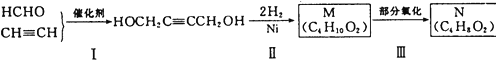
(1)反应Ⅰ的反应类型为_______________。
(2)HOCH2C≡CCH2OH分子中,可能在同一个平面的原子最多有________个。
(3)化合物M不可能发生的反应是_____________(填序号)。
A.氧化反应 B.取代反应 C.消去反应 D.加成反应 E.还原反应
(4)N的同分异构体中,含有两个甲基且属于酯类的有___________种。
(5)A与M互为同分异构体,有如下转化关系。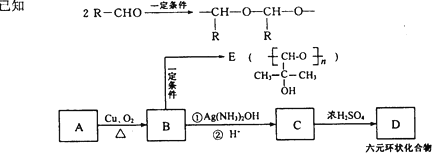
填写下列空白:
①A的结构简式为_______________,C生成D的反应类型是_______________
②D的化学式为______________________
③写出B与银氨溶液反应的化学方程式:______________________________
④在120℃时,由A、B、E组成的混合物wg与氧气充分反应,生成产物全部为气体时,消耗氧气质量[m(O2)]的范围为________________________。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s) +H2O(g)  CO(g) +H2(g)△H= +131.3kJ·mol-1
CO(g) +H2(g)△H= +131.3kJ·mol-1
一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同)。
a.容器中的压强不变 b.1mol H-H 键断裂的同时断裂2molH-O键
c.v正(CO)= v逆(H2O) d.c(CO) =c(H2)
(2)其他条件不变,升高温度其平衡移动,减小压强其平衡移动。
(3)达到平衡后,改变某一外界条件(不改变H2、CO的量),反应速率v与时间t的关系如下图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。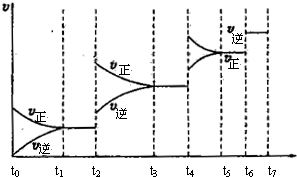
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是________,且各离子的物质的量之比为_______;肯定不含的阳离子是_______________,判断的理由是。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答: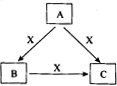
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为____________________________________________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(14分)已知在 25℃时,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH)/c(H+)________(填“增大”、“减小”或“不变”)。