向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c
(Cl-)=0.3mol/L。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
| A.原溶液的浓度约为0.13mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br-)= 0.4mol/L |
下表中实验操作能达到实验目的的是
| 实验操作 |
实验目的 |
|
| A |
向乙醚和苯酚的混合液中加入金属钠 |
确定乙醚中混有苯酚 |
| B |
向苯酚的饱和溶液中滴加稀溴水 |
制备三溴苯酚 |
| C |
将乙醇滴加到酸性KMnO4或K2Cr2O7溶液中 |
证明乙醇具有氧化性 |
| D |
将氯水加入浸泡过海带灰的溶液中 |
使溶液酸化 |
将铝片投入硫酸铜溶液中,会出现下列现象:铝片表面立刻有紫红色物质沉积,同时产生较多气泡,继而产生蓝色沉淀,混合物温度升高甚至发烫,产生气泡速率明显加快,铝片上下翻滚,溶液中出现黑色物质……。对以上现象的说法错误的是( )
| A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+ |
| B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+ |
| C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快 |
| D.溶液中出现的黑色物质可能是氧化铜 |
已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl—)>c(NH4+)>c(H+)>c(OH—)② c(Cl—)>c(NH4+)>c(OH—)>c(H+)
③ c(NH4+)>c(Cl—)>c(OH—)>c(H+)④ c(NH4+) =c(Cl—)>c(OH—)=c(H+)
下列说法正确的是: ( )
| A.若①正确,则溶液中溶质一定为NH4Cl |
| B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—) |
| C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH—) |
| D.溶质不同时,上述四种关系式均可能成立 |
下列变化不属于盐类水解反应的是()
①NH3+H2O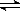 NH4++OH-②HCO3- + H2O
NH4++OH-②HCO3- + H2O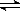 H2CO3+OH-
H2CO3+OH-
③HCO3-+H2O 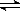 H3O++CO32-④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
H3O++CO32-④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
⑤A1O2-+HCO3-+H2O=Al(OH)3↓+CO32-⑥NH4++2H2O 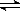 NH3·H2O+H3O+
NH3·H2O+H3O+
| A.①③⑤ | B.②③⑤ | C.①④⑤ | D.①③ |
向紫色Cr2(SO4)3溶液中,加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色) +3OH-  Cr(OH)3(蓝灰色)
Cr(OH)3(蓝灰色)  CrO2- (绿色)+H+ + H2O,将上述悬浊液等分两份a和b。向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为( )
CrO2- (绿色)+H+ + H2O,将上述悬浊液等分两份a和b。向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为( )
| A |
B |
C |
D |
|
| a试管 |
紫色 |
蓝灰色 |
蓝色 |
绿色 |
| b试管 |
绿色 |
绿色 |
紫色 |
紫色 |