已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为。
在一定的温度下,对于反应2A(g)+B(g)2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图所示。试回答下列问题:
(1)p点时反应的v正 v逆(选填“>”、“<”或“=”)。
(2)此反应的正反应为 热反应(填“放”或“吸”)。
(3)a、b两点的正反应速率:va vb(“>”、“<”或“=”)。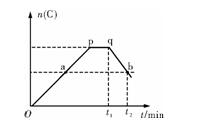
将0.65克Zn粉加入到200ml的足量CuSO4溶液中,锌粉完全溶解,(不考虑反应前后溶液体积的变化)求:
(1)析出铜的物质的量;(2分,写出计算过程)
(2)生成ZnSO4的物质的量及其物质的量浓度;(4分,写出计算过程)
(3)溶液的质量是增加了还是减少了,变化了多少克,说明理由;
有A、B、C、D四种化合物,其中A、C、D为盐且焰色反应均为黄色,而B是碱且透过钴玻璃观察焰色反应为紫色,A、C和盐酸反应均得到D的溶液,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸铜中溶液会出现蓝色沉淀E。试推断(写化学式)
A:________、B:________、C:_________、D:_________、E:
(1)在氧化还原反应中,化合价升高的物质,电子,被,做 剂,
化合价降低的物质, 电子,被,做剂,
(2)则在反应Fe2O3 + 3CO ="==" 2Fe + 3CO2中,是氧化剂,是还原剂,元素被氧化,元素被还原;是氧化产物,是还原产物。则每1mol Fe2O3参加反应转移的电子数目为: