(1)下列五种物质中,①Ar ② CO2 ③ SiO2 ④ Ba(OH)2 ⑤ K2S,
含有共价键的物质有_______________________________ (填序号)
分别写出 CO2 、 Ba(OH)2的电子式_______________________________
(2)在蔗糖溶液中加入稀硫酸并加热,稀硫酸的作用_____________________________
向上述溶液中加入新制的Cu(OH)2悬浊液,加热未见砖红色沉淀,其原因是_______________________________
(3)请用下列物质的转化或分离方法的序号填空(每一项只填写一种方法)。
①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取
把煤转化为焦炉气、煤焦油和焦炭等_______________________________
从原油中分离出汽油、煤油、柴油等_______________________________
将重油转化为汽油_______________________________
将海水淡化_______________________________  从海水得到的无水MgC12中提取金属镁
从海水得到的无水MgC12中提取金属镁
(4)乙烯和丙烯(C3H6)既可以分别发生加聚反应形成聚合物,也可以按一定比例相互发生加聚反应形成聚合物。
请写出三种有关聚合物的结构简式 、 、
(5)形成该聚合物 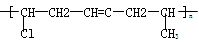 的单体有 ______________________________
的单体有 ______________________________
某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- 据此判断以下叙述中错误的是()
NH4++NH2- 据此判断以下叙述中错误的是()
| A.液氨中含有NH3、NH4+、NH2-等微粒 |
| B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数 |
| C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-) |
| D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-) |
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体____________________________。
②NaNH2溶于水的反应____________________________。
③类似于“H++OH—=H2O”的反应____________________________。
已知有关物质的溶、沸点数据如下表所示:
| 化合物 |
MgO |
Al2O3 |
MgCl 2 |
AlCl3 |
| 熔点/℃ |
2852 |
2072 |
714 |
190(2.5*105Pa) |
| 沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl 2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:__________________________________________________________________
(2)氯化铝是________________(填晶体类型)
(3)在500K和1.01*105Pa时,氯化铝的蒸气密度(换算为标准状况时)为11.92g/L,试确定氯化铝在蒸气状态时的化学式为___________________
(4)无水氯化铝在空气中剧烈“发烟”,其原因是________________
(5)设计可靠的实验证明MgCl 2、AlCl3所属的晶体类型,其实验方法是_____________.
试设计一套实验方案验证某白色粉末是纯碱。
2001年7月,有五只被人废弃的装金属钠的铁桶漂浮在珠江上,其中两只发生了剧烈爆炸,当时爆炸产生的白烟内还有许多没有燃烧的残渣,飘到附近后沉降下来,一遇到水就不停地冒泡,有时甚至还会突然着火。另外的三只被有关部门成功打捞。
(1)写出残渣遇水反应的主要化学方程式。
(2)如果你是现场工作人员,你能否用所学化学知识分析,这三只桶打捞上船后应采取什么应急处理措施?