X、Y、Z三种元素常见单质在常温下都是气体,在适当条件下可发生如下图所示变化,X、Y、Z为三种短周期元素,它们的原子序数之和为16.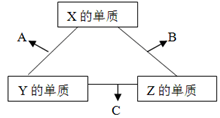
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.达到化学平衡时,Y的单质的体积分数仍为50%
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式。
(2)比较Y、Z离子半径大小( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。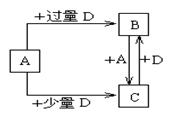
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: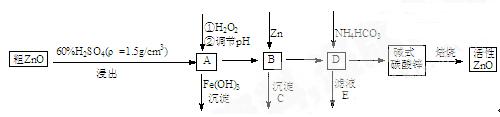
已知此溶液中Fe2+、 Fe3+、 Cu2+、 Zn2+形成氢氧化物的pH如下表
| 离子 |
开始沉沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.7 |
| Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制稀硫酸所需使用的玻璃仪器有:胶头滴管、_______、_______、_______。
(2)在A中加H2O2的目的之一是使溶液pH升高,使Fe3+沉淀完全。另外还有一个目的是;在A中(填”能”或”不能”)使Fe2+直接沉淀除去;
(3)要使A溶液顺利成为B溶液, 溶液的pH应控制在; B中加入Zn,既能降低氢离子浓度又能;
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式.
去冬以来,我国北方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂。保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分。聚丙烯酸钠就是一种高吸水性树脂。下面是丙烯合成聚丙烯酸钠的化工流程: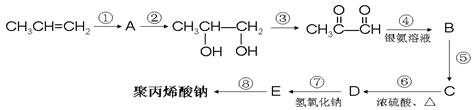
请回答下列问题:
(1) 上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
(2)写出A的结构简式_______________,D中的官能团有____________;
(3) F是D的同系物,式量比D大14,写出2种符合下列要求的F的同分异构体(不考虑顺反异构)__________________ , ______________________;
①链状分子 ②与新制氢氧化铜在加热条件下反应生成红色沉淀
③与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
(4)写出下列反应的化学方程式:
④_____________________________________________。
⑧_____________________________________________。
元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大。其相关信息如下:
| 元素 |
相关信息 |
| X |
基态原子核外有三个能级,每个能级的电子数都相等 |
| Y |
Y与Z不在同一周期,其原子核外未成对电子数比电子层数多1 |
| Z |
可与W形成两种化合物,且水溶液均呈酸性 |
| W |
是地壳中质量百分含量第二的金属元素 |
请回答:
(1)W的基态原子核外电子排布式是__________。Y单质分子中含个π键,试比较Y与同周期相邻的两种元素的第一电离能大小关系_____>_____>_____(填元素符号)
(2)X与Z形成的最简单的化合物是一种优良的溶剂,它是由(填“极性” 、“非极性”)键构成的(填“极性”、“非极性”)分子
(3)一定条件下Z与Y可形成YZ3,YZ3与水反应可生成一种弱酸和一种弱碱,试写出该反应的方程式______________________________
(4)X所形成的一种晶体具有高硬度、高熔点特性,属于______(填“分子”、 “原子”或“离子”)晶体,该晶体结构中Z-Z-Z键角为_______。
.已知常温下0.4mol/L的某酸的pH值为3,则由水电离出的OH-浓度为,该酸的电离度为:。