W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式 。
(2)比较Y、Z离子半径大小 ( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。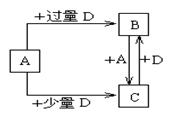
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是;
②外电路中的电子是从电极流向电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的PH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________。
| A.Na2O2+2HCl ="=" 2NaCl+H2O2 |
| B.Ag2O+H2O2="=" 2Ag+O2↑+H2O |
| C.2H2O2 ="=" 2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH ="=" 2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是_________(填字母代号)。
(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①写出该反应的离子方程式并配平___________________________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数目为_________。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O==A+NH3↑,试指出生成物A的化学式为__________________,并阐明H2O2被称为“绿色氧化剂”的理由是_____________________________________________。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题: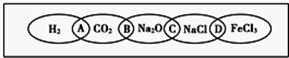
(1)请将分类依据代号填入相应的括号内:
()两种物质都不是电解质
()两种物质都是钠的化合物
()两种物质都是氧化物
()两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是_______________________________________。
(Ⅰ)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
①.除去NaOH溶液中悬浮的CaCO3;②.从溴水中提取溴;
③.用自来水制取蒸馏水;④.与海水晒盐原理相符的是。
(Ⅱ)某化学课外小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗上口的小孔;
H.静置、分层。
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
________→________→________→A→________→G→E→F。
(2)上述G步骤操作的目的是_________________________________________________。
在氧化还原反应中,氧化剂电子,发生的反应是反应;
还原剂电子,发生的反应是____________反应。
铁与氯气反应的化学方程式为,生成物中铁是价,铁与盐酸反应的离子程式为,生成物中铁是_____价。