(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
下列实验操作会导致实验结果偏低的是
①配制100 g 10%的CuSO4溶液,称取10g CuSO4晶体溶于90g水中
②测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的H2SO4溶液,定容时俯视容量瓶的刻度线
④中和滴定时,用含KOH的NaOH配制成的标准溶液滴定未知浓度的HCl
| A.只有① |
| B.只有② |
| C.②③④ |
| D.①③④ |
用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸时,下列操作会导致测定结果偏高的是
| A.酸式滴定管用蒸馏水洗净后,直接注入未知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,直接注入未知浓度的盐酸 |
| C.滴定前,碱式滴定管尖嘴部分有气泡;滴定后,气泡没有了 |
| D.读数时,视线与滴定管内液体的凹液面的最低处保持水平 |
为了证明氯酸钾晶体中含氯元素,选用给出的试剂和操作,其操作顺序正确的是
①滴加AgNO3溶液
②加水溶解
③过滤、取滤液
④与二氧化锰混合加热
⑤加稀HNO3
⑥与浓盐酸反应
⑦加NaOH溶液加热
⑧加淀粉碘化钾
| A.⑥⑦①⑤ |
| B.⑥⑧ |
| C.④②③①⑤ |
| D.②①⑤ |
下图是两套实验室制气装置(省去了铁架台和锥形瓶中的药品)用于发生、干燥和收集气体,下列选项中正确的是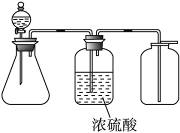

图1 图2
| A |
二氧化锰和浓盐酸 |
应选用图1装置 |
| B |
浓盐酸和浓硫酸 |
图1和图2装置均不能选用 |
| C |
生石灰和浓氨水 |
应选用图2装置 |
| D |
过氧化钠和水 |
应选用图2装置 |
实验现象的认真观察和准确描述是化学实验的基本要求,下列现象描述正确的是
| A.用碳棒电解CuSO4溶液:正极上有红色的Cu析出,负极上有无色H2气泡冒出 |
| B.向氯水中通入SO2:氯水的黄绿色褪去,有淡黄色沉淀生成 |
| C.常温下向苯酚钠溶液中通入过量CO2:溶液变浑浊,加热后变澄清 |
| D.向FeSO4溶液中滴加KSCN溶液,再加氯水:开始无现象,滴加氯水后出现血红色沉淀 |