根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积 m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
|
|
|
|
120 |
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
|
|
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下: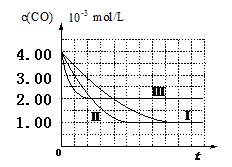
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
(16分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题:
(1)仪器中装入的试剂:B_________ 、D___________;
(2)连接好装置后应首先_________________________,(填写操作)
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________;在这两步之间还应进行的操作是____________________________
(4)写出反应过程中反应管E中的化学方程式:_______________,
(5)从实验中测得了下列数据
①空E管的质量a; ②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的化学方程式:。
(2)写出试剂Y的名称:。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和;
假设2:存在三种成分:NaHCO3和、。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中。 |
|
| 步骤2: |
情况①: 情况②: |
| 步骤3: |
(4)D中黄棕色的气体化学式为。
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)装置A中发生反应的离子方程式为_____________________________________
(2)装置B中试剂Y应为________________________________________
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),C中含氯元素的物质是一种盐,且含有NaHCO3。现对C中的成分进行猜想和探究:
①提出合理假设
假设一:存在两种成分,为NaHCO3、____________
假设二:存在三种成分,为NaHCO3、_________________________________
②设计方案并实验。请在表格中写出实验步骤以及预期现象和结论。
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中。 |
固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液。 |
如果 如果_______________________ |
| 步骤3: |
有白色沉淀生成,C的成分有NaCl |
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假
设二成立。
(4)该实验装置明显存在不足之处,改进的措施为__________________________________________
(5)若C中有0.1molCl2参加反应,且假设一成立,由此可推知C中反应生成的含氯氧化物为
(写化学式)。
(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若
,则整个装置气密性良好。装置E的作用是。装置F中为溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
| A.蒸馏水 | B.饱和Na2SO3溶液 |
| C.饱和NaHSO3溶液 | D.饱和NaHCO3溶液 |
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是_________________,写出有关离子方程式:_____________。
化学是一门以实验为基础的科学,化学实验是化学学习的重要内容。
(1)根据你掌握的知识,下列描述正确的是(填序号)
①将0.2mo1·L-1FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
②将95g蒸馏水倒入盛有5g氯化钠的200ml的烧杯中,搅拌溶解,配制5%的食盐水;
③实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
④使用容量瓶,滴定管、分液漏斗时,首先应检验仪器是否漏水;
⑤向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-。
(2)实验室中需要480ml0.4mo1·L-1CuSO4溶液,应称取硫酸铜晶体(CuSO4·5H2O)的质量是g;所用仪器除托盘天平(带砝码)、量筒、烧杯、玻璃棒、药匙外,还缺少的玻璃仪器是;在观察液面定容时,若俯视刻度线,会使所配制的溶液的浓度;(填“偏高、偏低或无影响”下同)转移溶液前容量瓶内有少量蒸馏水;