(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若
,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
| A.蒸馏水 | B.饱和Na2SO3溶液 |
| C.饱和NaHSO3溶液 | D.饱和NaHCO3溶液 |
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是_________________,写出有关离子方程式:_____________。
已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验: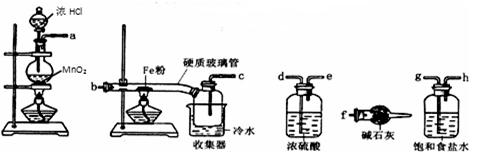
(1)装置的连接顺序为。
(2)饱和食盐水的作用是。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_____________________。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明;
实验②的目的是;
得出结论:溶液褪色的原因是。
Ⅰ.实验室制备一氧化碳原理是:HCOOH H2O+CO↑。
H2O+CO↑。
(1)从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置,并标明容器中的试剂。
(2)装置Ⅱ的作用是。
Ⅱ.实验室制备四水甲酸铜[Cu(HCOO)2·4H2O]晶体实验步骤如下:
(1)碱式碳酸铜的制备:
a、步骤ⅰ是将一定量胆矾和NaHCO3固体一起放到研钵中研磨,其目的是。
b、步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到(填写实验现象),说明温度过高。
c、相关的化学方程式是。
(2)四水甲酸铜[Cu(HCOO)2·4H2O]晶体的制备:
将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。然后蒸发,冷却,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
a、相关的化学方程式是。
b、“趁热过滤”中,必须“趁热”的原因是。
c、用乙醇洗涤晶体的目的是。
Ⅲ.探究小组用滴定法测定四水甲酸铜[Cu(HCOO)2·4H2O](Mr=226)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2++H2Y2- =CuY2-+2H+,写出:(1)计算Cu(HCOO)2·4H2O质量分数的表达式ω=______;
(2)下列操作会导致Cu(HCOO)2·4H2O含量的测定结果偏高的是___________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
学习小组设计了如下图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质: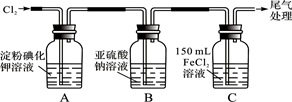
(1)通入氯气后,A中的现象是。C装置中发生反应的离子方程式为:。
(2)通入氯气一段时间后,B瓶的溶液中有一部分SO32-氧化成SO42-。该试验方案,检验B瓶溶液中Cl-和SO42-的存在。
| 实 验 步 骤 |
预期现象和结论 |
| 步骤1:取适量B瓶中溶液于一干净试管中,滴加。 |
若产生白色沉淀,则B瓶溶液中存在SO42-。 |
 步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2 mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置。 步骤2:另取适量B瓶中溶液于试管一干净试管中,滴加过量的2 mol/L HNO3和l mol/L Ba(NO3)2溶液,振荡,静置。 |
产生白色沉淀。 |
| 步骤3:取步骤2后试管中的上层清液于一干净试管中,滴加0. 1 mol/L AgNO3溶液,振荡。 |
。 |
实验步骤2的目的是:。
(3)为准确测定通入氯气一段时间后C瓶中剩余FeCl2的物质的量。实验如下:
①配制250 mL 溶液:将C瓶中全部溶液取出盛于250 mL容量瓶中,并准确配制成250 mL溶液。确保C瓶中的溶液全部取出(溶质无损失),需进行的操作是。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,将0.20 mol/L KMnO4溶液装入滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应方程式: Fe2++MnO4-+H+ — Fe3++Mn2++H2O,未配平)
③计算:C瓶中剩余FeCl2的物质的量,n(FeCl2)=mol。
(16分)(1)下图所示都是实验室中制取气体的装置,其中能实现随开随用,随关随停的是____________,其中仪器B的名称是____________。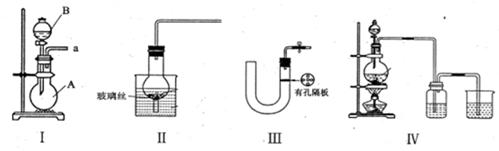
(2)请简述检验装置III的气密性的方法_________________________________.
(3)实验室利用铜和浓硫酸制取SO2,可选择上述气体发生装置的_________来实现。请写出其反应的化学方程式___________________________.
(4)若要用浓硫酸(质量分数为98%,密度为1.84g/mL)配制1 mol/L的稀硫酸500mL,则需要量取浓硫酸的体积为__________mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、_________。
(5)①若在100 ml 18 mol/L浓硫酸中加入过最铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是__________________。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程_。
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: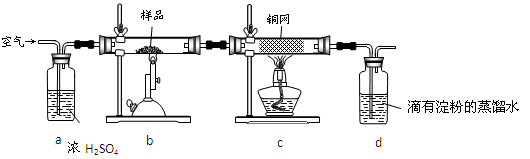
现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的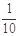 置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
(1)将样品研细后再反应,其目的是。
(2)装置a和c的作用分别是____和____(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是。
(4)通过计算可知,该黄铜矿的纯度为。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是(填序号)。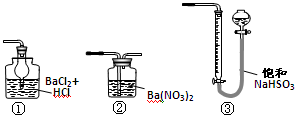
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。