下列化学式中,只能用来表示官能团的是( )
| A.P | B.C6H12 | C.C2H5Br | D.C2H4Cl2 |
下列有机物中含有两种官能团的是( )
A.CH2="=CHCl" 
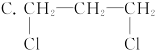
1999年4月,发生在比利时的“二 英”污染,极大地影响了该国的食品出口量。“二
英”污染,极大地影响了该国的食品出口量。“二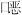 英”是两大类芳香族化合物的总称,其中四氯代二苯并二
英”是两大类芳香族化合物的总称,其中四氯代二苯并二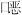 英毒性最大。四氯代二苯并二
英毒性最大。四氯代二苯并二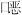 英的结构简式为
英的结构简式为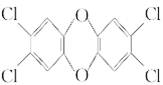 ,有关该化合物的说法不正确的是( )
,有关该化合物的说法不正确的是( )
| A.分子式为C12H8O2Cl4 | B.分子中所有原子都可能处于同一平面 |
| C.是一种难溶于水的物质 | D.可以发生取代反应 |
下列有关胶体和溶液的比较中正确的是 ( )
| A.溶液呈电中性,胶体带有电荷 |
| B.溶液中溶质粒子运动有规律,胶体粒子运动无规律 |
| C.溶液中通过光束没有特殊现象,胶体中通过光束有丁达尔现象 |
| D.通电后,溶液中溶质粒子分别向两极移动,而胶体中分散质粒子向某一极移动 |
下列说法不正确的是( )
| A.磷酸的摩尔质量与NA个磷酸分子的质量在数值上相等 |
| B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C.32 g氧气所含的原子数目约为2×6.02×1023 |
| D.常温常压下,0.5 ×6.02 ×1023个一氧化碳分子所占体积是11.2 L |