X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y), Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料。下列说法不正确的是
| A.X的氢化物X2H2分子中含有2个σ键和3个π键 |
| B.XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C.单质M的晶体是体心立方堆积,M的配位数是8 |
| D.由元素X与Z形成的化合物中只含共价键 |
某有机化合物A的相对分子质量大于100,小于130。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为
| A.1 | B.2 | C.3 | D.4 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知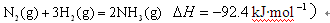
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
NH3的浓度(mol·L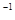 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
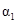 |
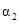 |
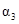 |
下列说法正确的是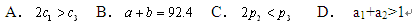
已知25℃,AgI饱和溶液中,C(Ag+)=1.22×10-8mol/L,AgCl饱和溶液中,
C(Ag+)=1.25×10-5mol/L,若在5ml含有KCl和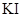 各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
| A.C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-) |
| B.C(K+)>C(NO3-)>C(Ag+)> (Cl-)>(I-) |
| C.C(NO3-)>(K+)> C(Ag+)> (Cl-)>(I-) |
| D.(K+)> C(NO3-)>C(Ag+)=(Cl-)+(I-) |
浓度为2mol·L-1的氢溴酸溶液VL,欲使其浓度变为4 mol·L-1,以下列出的方法中,可行的为
| A.通入标况下的HBr气体44.8L |
| B.加入10 mol·L-1氢溴酸0.6VL,再将溶液稀释至2VL |
| C.蒸发掉0.5L水 |
| D.将溶液加热蒸发浓缩至0.5V |
如右图所示,表示反应2SO2(g)+O2 2SO3(g) ,△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) ,△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是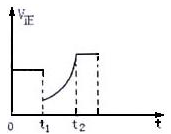
| A.t1时增加了SO2和O2的浓度,平衡向正反应方向移动; |
| B.t1降低了温度,平衡向正反应方向移动; |
| C.t1时减小了压强,平衡向逆反应方向移动; |
| D.t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |