化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 |
影响条件 |
| ①食物放在冰箱里能延长保质期 |
温度(示例) |
| ②实验室将块状药品研细,再进行反应 |
____________ |
| ③用H2O2分解制O2时,加入MnO2 |
____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 |
____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示: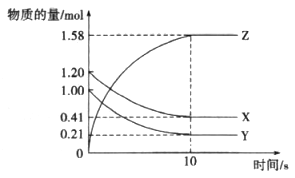
①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: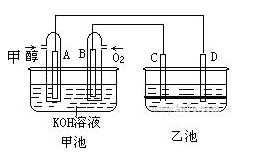
(1)通入甲醇的惰性电极的电极反应式为。若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为。
(2)在乙池反应过程中,可以观察到电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 mol·L—1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测NaOH溶液的浓度为mol·L—1。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)  CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH=CH2(g)+H2(g)的△H=kJ·mol-1。
CH3CH=CH2(g)+H2(g)的△H=kJ·mol-1。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3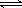 HCO3-+H+的电离平衡常数Ka1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1=。(已知:10-5.60=2.5×10-6)
(3)在1 L浓度为c mol/LCH3COOH溶液中,CH3COOH分子、H+和CH3COO-离子物质的量之和为nc mol,则CH3COOH在该温度下的电离度为×100%
恒容容积为VL的密闭容器中发生2NO2 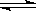 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。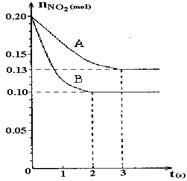
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是。
A.有、无催化剂 B.温度不同
C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式:,并比较K800℃K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)=。
(4)不能说明该反应已达到平衡状态的是。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变D.气体的密度保持不变
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号)。
第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金。某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金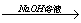 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金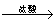 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金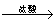 溶液
溶液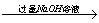 悬浊液
悬浊液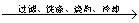 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)写出方案一中发生反应的离子方程式。
(2)实验小组根据方案二设计了两个实验装置,如下圈(图中的铁架台已省略)。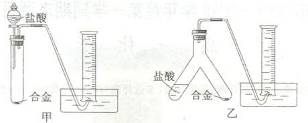
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的。
(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量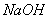 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入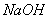 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示: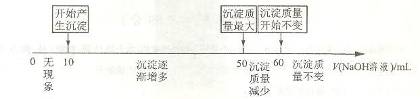
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? (选填“能”或“不能”)_____________.
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由。
②若能求出合金中镁的质量分数,则镁的质量分数为。