(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。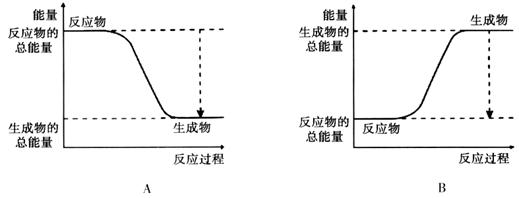
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 |
H—H |
O=O |
H—O |
| 键能kJ/mol |
436 |
496 |
463 |
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:
(1)依据反应: 设计的原电池如图所示。
设计的原电池如图所示。
则电解质溶液Y是________________ (填化学式),X的电极反应式___________________,盐桥中的Cl-移向_______________溶液(填化学式)。若将盐桥换成铜丝,则X电极名称是____________。
(2) 利用下图的装置可以模拟铁的电化学防护:
若Z为碳棒,为延缓铁腐蚀,K应置于____处,总反应的离子方程式为__________________ ;若Z为锌,开关K置于M处,该电化学防护法称为____________________。
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:
①反应的热化学方程式为____________________________________________。
②已知:

则

(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) ="=" NH3(g) ΔH = 。
(3)下图是一个化学过程的示意图:(已知电解质溶液均过量)
①甲装置中通入CH4的电极反应式为
②一段时间,当丙池中产生11.2L(标准状况下)气体时,则乙池中产生气体的物质的量为 ,若要使丙池恢复电解前的状态,应向丙池中加入 。
25℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10﹣5 |
K1=4.3×10﹣7 K2=5.6×10﹣11 |
3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是: ;
A.c(H+)B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣)D.c (OH﹣)/ c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.
则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)= .(填准确数值).
(5分)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 (写出计算过程)。
双氧水(H2O2)和水都是极弱电解质,但H2O2比水更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐在一定条件下也可以形成酸式盐.请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:
(3)水电离生成H3O+和OH﹣叫做水的自偶电离.同水一样,H2O2也有极微弱的自偶电离,其自偶电离方程式为: .