对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
| A.该反应既属于四种基本类型的反应,又属于氧化还原反应 |
| B.氧元素被还原,硫元素被氧化 |
| C.每有3 mol S参加反应转移6 mol电子 |
| D.S既是氧化剂又是还原剂 |
现在频频出现的大雾天气,致使高速公路关闭,航班停飞。雾中小水滴直径范围是
| A.小于0.1nm | B.大于100nm |
| C.在1nm—100nm间 | D.小于1nm |
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线如图下图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是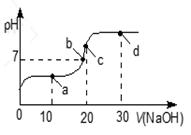
| A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) |
| B.b点时:c( Na+) ="c(" CH3COO-)>c(H+)="c(" OH-) |
| C.c点时:c(OH-)=c(CH3COOH) +c(H+) |
| D.d点时:c(Na+)>c(OH-) >c(CH3COO-)>c(H+) |
在2L的密闭容器中,起始时均投入2molCO,在不同条件下发生反应:CO(g) +2H2(g)  CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
| A.T1<T2 |
| B.同一温度下,n(H2)/n(CO)越大,平衡常数也越大 |
| C.T1℃时该反应的平衡常数为4.0 |
D.相同条件下 越大,CO和H2的转化率也越大 越大,CO和H2的转化率也越大 |
下列实验装置图合理的是
A.装置①所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
| B.装置②能构成锌铜原电池 |
| C.装置③可用于粗铜的电解精炼 |
| D.装置④可用于在实验室测定中和反应的反应热 |
下列说法不正确的是
| A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
| B.常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 |
| C.BaSO4(s)+4C(s)===BaS(s)+4CO(g)室温下不能自发进行,说明该反应的ΔH﹤0 |
| D.0.1mol·L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |