下述实验设计能够达到目的的是 ( )
| 编号 |
实验目的 |
实验设计 |
| A |
除去CO2中少量的SO2 |
将混合气体通过饱和Na2CO3溶液 |
| B |
除去Cu粉中混有的CuO |
向混合物中滴加适量稀硝酸 |
| C |
证明钠的金属活动性比铝强 |
向AlCl3溶液中投入金属钠 |
| D |
证明H2CO3酸性比H2SiO3强 |
将CO2通入Na2SiO3溶液中 |
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是()
2NH3(g) ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是()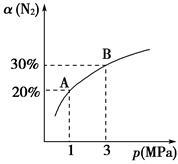
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g 锌粒,则下图所示比较符合客观事实的是()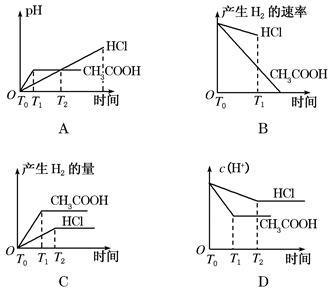
电解100 mL含c(H+)=0.30 mol·L-1下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是()
| A.0.10 mol·L-1AgNO3溶液 |
| B.0.10 mol·L-1ZnSO4溶液 |
| C.0.20 mol·L-1CuCl2溶液 |
| D.0.20 mol·L-1Pb(NO3)2溶液 |
电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理,下列说法正确的是()
| A.图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生 |
| C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2 |
| D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
依据下列甲、乙、丙三图,判断下列叙述不正确的是()
| A.甲是原电池,乙是电镀装置 |
| B.甲、乙装置中,锌极上均发生氧化反应 |
| C.乙、丙装置中,阳极均发生氧化反应而溶解 |
| D.乙、丙装置中,c(Cu2+)基本不变 |