下列各组粒子,属于同种核素的是 (填编号,下同),互为同位素的是 ,互为同素异形体的是 ,互为同分异构体的是 。
①16O2和18O3 ②质子数相同而中子数不同的两种粒子
③ ④
④ 和
和 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖 ⑥
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
| 阳离子 |
Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________ _________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
下图中A、D均为碳棒,B为铝棒,C为铁棒,硫酸钠溶液在实验前采取了煮沸处理。B在实验时才插入溶液中。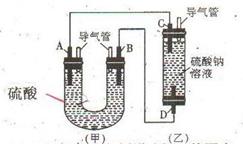
(1)从装置的特点判断,甲、乙装置中_______是原电池,负极的电极反应式为_____________________。
(2)实验开始一段时间后乙池溶液中的现象是,_______________________,若用某电解质溶液代替硫酸钠溶液也能出现相同的现象,则此溶液可以是
A.NaOH溶液 B.AgNO3溶液
C.NaCl溶液 D.CuSO4溶液
(3)实验前煮沸硫酸钠溶液的目的是______________________________ 。
(4)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,此时D电极上的电极反应式为_________________。乙装置里除两电极有明显现象外,还可以看到的现象是________________________,产生该现象的化学方程式是_____________________________________。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);右图表示某次合成实验过程中甲醇的体积分数
CH3OH(g);右图表示某次合成实验过程中甲醇的体积分数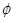 (CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如图所示的装置: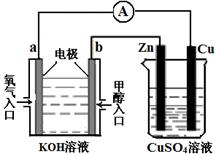
①则该装置中b为 极。
②当铜片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为 L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方为 。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。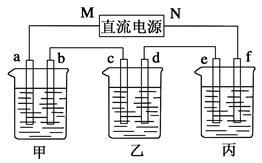
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题: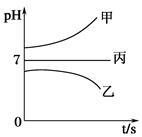
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA-HA-
H++HA-HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。