X、Y是原子序数依次增大的2种短周期元素(稀有气体除外)。其中,X元素原子的K、M层电子数之和比L层电子数少3,Y元素的最高正化合价是其最低负化合价绝对值的3倍。
请回答:X元素是 (填元素符号)。
Y的一种氧化物,其氧元素质量分数为50%,它具有的性质是 (填序号)。
① 能使品红溶液褪色 ② 能使酚酞试液变红
③ 在一定条件下能被氧气氧化 ④ 能使紫色石蕊试液变红
中学常见的某反应的化学方程式为A+B―→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与B反应的离子方程式为________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为__________________。
(3)若该反应是实验室制取C气体的反应。已知C是无色刺激性气味的气体,其水溶液呈弱碱性,C能发生催化氧化反应。写出该反应的化学方程式________________。
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
⑴该反应中的还原剂是。
⑵该反应中,发生还原反应的过程是→。
⑶写出该反应的化学方程式,并标出电子转移的方向和数目。
⑷如反应转移了0.3mol电子,则产生的气体在标准状况下体积为。
(9分)取1.43g Na2CO3·XH2O 溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·XH2O 的摩尔质量(3)x值_________
标准状况下,将X L HCl气体完全溶于1.00L水(密度为1.00g/cm3)中,得到质量分数为36.5%(密度为1.18g/cm3)的溶液,问:(计算结果保留到小数点后2位)
(1)X为。
(2)所得溶液的体积为L。
(3)所得溶液的物质的量浓度为。
海藻中提取碘的流程如图:
(1)指出提取碘的过程中有关实验操作名称:①__________,③________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是______ 。
| A.苯、酒精 | B.四氯化碳、苯 | C.汽油、醋酸 | D.汽油、氨水 |
(3)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
(注:下图片中深色区为紫红色溶液)
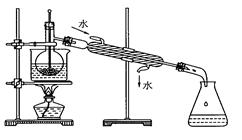
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。