现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第3周期元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图__________________________;
(2)元素Y与元素Z相比,金属性较强的是__________________(用元素符号表示),下列表述中能证明这一事实的是_________________(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式___________,并写出该化合物与水反应的离子方程式______;
(4)元素T和氢元素以原子个数比1∶1化合形成的化合物属于______________,元素Z与元素T形成的化合物属于____________________(以上两空选填“共价化合物”或“离子化合物”)。
“材料”的发现和使用往往会极大 地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾
引起计算机的一场“革命”。这种材料可以按下列方法制备: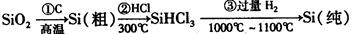
①写出步骤①的化学方程式 。
。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式。
③请写出二氧化硅与氢氟酸反应的化学方程式。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:,。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是,三氯化铁溶液可以加速伤口止血,请简述原因
。
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: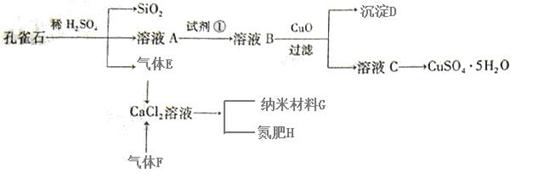
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为(填代号)。
a.KMnO4b.(NH4)2S c.H2O2
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为。加入CuO作用是。
(2)加入试剂①后,溶液中反应的离子方程式,并用单线桥标出电子转移的方向和数目:
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入)(填化学式)。写出该反应的化学方程式。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用;取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为。
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是(填序号)。
| A.硫酸铜 | B.二氧化氯 | C.臭氧 | D.硫酸亚铁 |
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 某厂含锌废水水质 |
国家环保标准值 |
|
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为mg/L,(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下: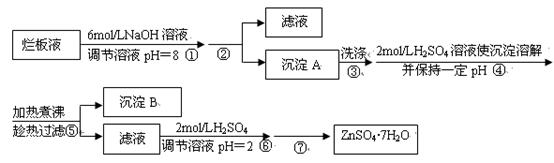
已知有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe3+ |
1.9 |
3.2 |
| Zn2+ |
6.4 |
8.0 |
(1)沉淀B的主要成分是。
(2)第②步操作中需要的玻璃仪器有。
(3)第④步中pH应保持在范围内。
(4)第⑥步调节溶液pH=2的目的是。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、和过滤。
( 6分) A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则A的分子式为。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为,试用化学方程式表示该物质的一个重要应用。
(3)若C是红棕色气体,则A的化学式可能为。