下表为元素周期表的一部分,请回答有关问题:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是 和 。
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素形成的单质与⑥、⑨最高价氧化物的水化物反应的化学方程式: 、 。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为: 2NaIO3+5NaHS O3=3NaHSO4+2Na2SO4+I2+H2O
O3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化, _____________是氧化剂。
(2)用双线桥标出电子转移方向和数目。_____________________________________
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是。
(2)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g) △H=" -574" kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g) △H=" -1160" kJ·mol-1 根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时△H=。
(3)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示,则n3 =p=  。
。
A、B、C、D、E、F六种中学化学中常见的物质,有转化关系(见图):
(1)若A、C、E皆为氧化物,且E为有毒气体,B、D、F皆为非金属单质,且D为气体。则A的结构式为,1molC中含有个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体。则:
①A、C、E沸点由高到低的顺序为(填化学式);A、C、E三种气态氢化物稳定性最强的是(填化学式)。
②B跟C反应生成E和F的化学方程式为。③A跟D常温下反应可生成一种单质,化学方程式为 。
。
(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出配平的该反应的化学方程式:______________________ →_______________________
②被氧化的元素是。
(2)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①写出CuH在氯气中燃烧的化学反应方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________________________________________
有A、B、C、D四种短周期元素在周期表中相对位置如右图:
| A |
|||
| B |
C |
D |
(1)A与D形成的液态化合物是常见的重要有机溶剂,则A、B、C、D四种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_______>_________>___________>______(用化学式表示),B、C、D三种元素的第一电离能由大到小的顺序是:______________(用元素符号表示)(2)X、Y为C、D两种元素形成的单质。标准状况下,X的密度为3.17 g/L。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol/L Z水溶液pH=13。X、Y、Z有如图转化关系: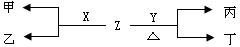
①写出X与Z反应的离子方程式:_____________________________
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化学式_______,丁的水溶液pH>7的原因:___________________________________(用离子方程式表示)
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式_________。