(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。锌片上发生的电极反应: ;银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:产生氢气的体积(标准状况)。
(每个方程式2分,其余每空1分,共8分)现有下列物质:
①KI②铜③稀硝酸 ④NH3⑤NaHSO4⑥Ba(OH)2⑦氢氧化铁胶体 ⑧氨水
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 |
电解质 |
盐 |
非电解质 |
混合物 |
| 属于该类的物质 |
(2)上述某两种物质在溶液中可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式。
(3)物质①的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为。
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。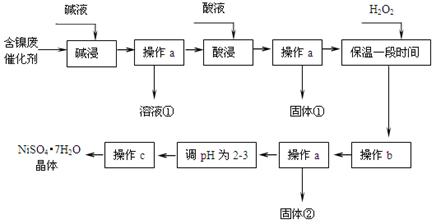
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、蒸发皿外还需要的主要仪器为。
(2)“碱浸”过程中发生的离子方程式是。
(3)“酸浸”时所加入的酸是(填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:。
(5)“调pH为2~3”的目的是。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。
有一瓶澄清溶液,其中可能含有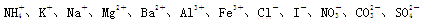
中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。排除存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色。排除______存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
证明存在,又排除存在。
(5)根据上述实验事实确定:
①该溶液中肯定存在的离子是;
②肯定不存在的离子是;
③还不能确定是否存在的离子是。
如图是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,
请回答下列问题:
(1)焰火利用了部分金属的元素特征的反应,该反应属于(填“物理”或“化学”)变化。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体,且发现只有氯元素的化合价发生变化。请写出该反应的方程式。
(3)如图所示的五元环代表A、B、C、D、E五种化合物,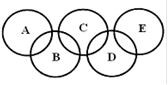
圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为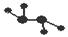 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①D的化学式是_________.
②A、B、E中均含有的一种元素名称为______________。
③B的电子式是______________。
④C与纯碱反应的化学方程式为。
(8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-)b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—