乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
③2CH3CH2OH  CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。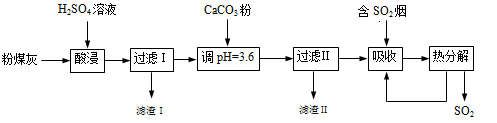
(1)酸浸时反应的化学方程式为 ;滤渣Ⅰ的主要成分为 (填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为 (填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是 (用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是 ;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 gNaHCO3固体的烧杯中加入10 mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g/mL 20%的盐酸(20℃),搅拌,测量温度T3。
得到下表的数据: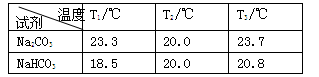
回答下列问题:
(1)NaHCO3溶于水显______性,其原因是 (用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解_______(填“是”或“否”)。
(3)分析表1的数据得出:Na2CO3固体溶于水______,NaHCO3固体溶于水______(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10 mL水(20℃)的烧杯中加入10 mL_____,搅拌,测量温度为22.2℃。
(5)结合上述探究,下列说法正确的是__________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
若按A方案进行实验,则原混合物中NaHCO3的质量分数为_____(用含a、b的代数式表示)
附表:溶解度表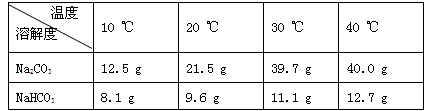
如图1是某化学兴趣小组进行丁烷裂解的实验流程.(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,铁架台等已省略.)按下图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…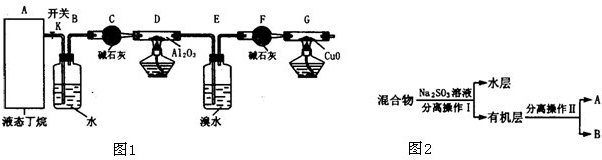
(1)这三步操作的先后顺序依次是
(2)B装置所起的作用是
(3)假定丁烷按C4H10→C2H6+C2H4和C4H10→CH4+C3H6的方式完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中,甲烷与乙烷的物质的量之比为 (假定流经D、G装置中的气体能完全反应)
(4)若对E装置中的混合物再按图2流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ Ⅱ
Na2SO3溶液的作用是 (用离子方程式表示)
②已知B的碳原子数大于A的碳原子数,请写出B的结构简式
下图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程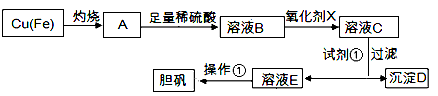
已知:
| 溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH |
≥3.7 |
≥6.4 |
≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是________(填字母)。
A.NaClOB.H2O2C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(3)操作①的名称是________。
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是________。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是________________(用离子方程式表示)。
某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体。
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收。
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:_________________________。
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:_________________________;
假设三:无色气体是SO2与H2的混合气体。
【实验验证】请你设计实验验证上述假设三,完成下表中内容。小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选。
| 实验方案与步骤 |
实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; |
若_____________________, 则无色气体中有SO2。 |
| 2.________________________________________________________________________________________________________________ |
若_______________________,则无色气体中有H2。 结合以上实验可知假设三成立。 |