已知有机化合物 A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为 。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为 。
(3)C的核磁共振氢谱中有 个峰;D也可以由卤代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式 。
(4)A的结构简式是 。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式: 。
a.能够发生水解 b.能发生银镜反应
c.能够与FeCl3溶液显紫色 d.苯环上的一氯代物只有一种
锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: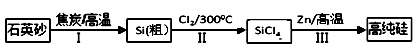
(1)1mol焦炭在过程Ⅰ中失去mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s) Si(S)+2ZnCl2(g) △H<0下列说法正确的是()
Si(S)+2ZnCl2(g) △H<0下列说法正确的是()
| A.还原过程需在无氧的气氛中进行 |
| B.投入1molZn可生成14g还原产物 |
| C.增加SiCl4(g)的量,该反应平衡常数不变 |
| D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=(两位有效数字)。
氧和硫的化合物在化工生产上应用非常广泛。试回答下列问题:
(1)O3可通过电解稀硫酸(原理如下图所示,该条件下3O2=2O3可以发生)制得。图中阳极为(填A或B)。若C处通入O2,则A极的电极反应式为:,若C处不通入O2 ,D、E处分别收集到1mol和0.4mol气体, 则E处收集的气体中O3所占的体积分数为(忽略O3 的分解)。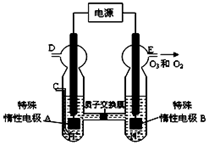
(2)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。己知:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235" kJ/mol;
2 Ag2O(s)===4Ag(s)+O2(g);△H = +60kJ/mol;
则反应 2O3(g)= 3O2(g)的△H = 。
(3)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g)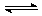 SO2(g)+Cl2(g)△H=+98 kJ·mol-1。某温度时向体积为2 L的恒容密闭容器中充入0.20mol SO2Cl2,达到平衡时,容器中含0.1mol SO2,该温度时反应的平衡常数为____(请带单位)。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g)△H=+98 kJ·mol-1。某温度时向体积为2 L的恒容密闭容器中充入0.20mol SO2Cl2,达到平衡时,容器中含0.1mol SO2,该温度时反应的平衡常数为____(请带单位)。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(4)对(3)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。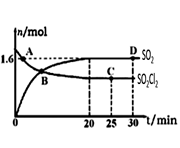
①0~20min反应的平均速率υ(SO2Cl2)=___________。
②下列叙述正确的是
A.A点υ正(SO2Cl2)>υ逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强 ,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
[化学---选修3:物质结构与性质](15分)太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式:。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为(用元素符号表示)。
(3)SeO3分子的立体构型为。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是。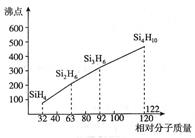
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式:。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为;若该晶体的晶胞参数为a pm,则该合金密度为g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
[化学---选修2:化学与技术](15分)银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
(1)熔炼时被氧化的元素是,酸浸时反应的离子方程式为。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是。
(2)操作a是,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+Al2O3 +↑。
+↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+ Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差g。
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=,平衡时N2的转化率α(N2)=。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(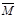 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是。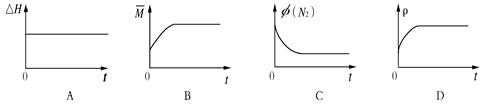
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为g(假设溶液电解前后体积不变)。