常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b |
下图所示的实验装置或表示的实验操作不正确的是()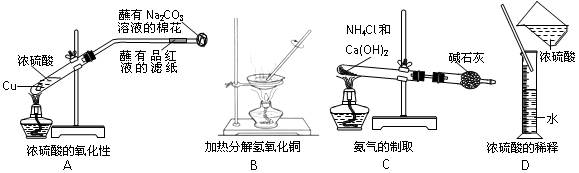
下列气体中有毒、有刺激性气味且有颜色的气体是()
| A.H2S | B.NH3 | C.NO2 | D.SO2 |
随着社会的进步,环境问题越来越引起人类的重视,下列有关环境问题描述不正确的是()
| A.水体的富营养化主要是向水体中排放大量含N、P等物质造成的 |
| B.低碳生活是指少用煤炭的生活 |
| C.含氟氯等化合物的大量排放造成了臭氧层空洞 |
| D.光化学烟雾的始作俑者包括NO、NO2等多种气体 |
将a mol FeCl3和b mol FeS混合物加入到某浓度的氢硫酸中,充分反应后,氢硫酸的浓度没有改变(不考虑溶液体积的变化),则a、b的关系是()
| A.a>2b | B.a="b" | C.a≤ 2b | D.a ≥b |
有a、b、c、d四种元素,a、b为同周期元素,c、d为同主族元素。已知a的阳离子和d的阴离子具有相同的电子层结构。b的阴离子和c的阴离子电子层结构相同。且c离子的电荷数大于b离子。则下列说法正确的是( )
①原子序数:d <b< c< a②原子序数:d< a <c <b
③原子序数:d< a< b< c④离子半径:b >c> d> a
⑤离子半径:b> c >a> d⑥离子半径:c> b >d> a
| A.③④ | B.②⑥ | C.①⑤ | D.②④ |