某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
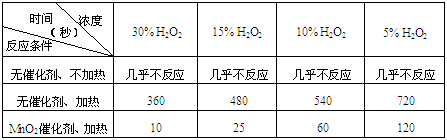
① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
① 写出H2O2发生的化学反应方程式 _______________ ______。
② 实验结果说明催化剂作用的大小与________ _________有关。
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中,发生反应:3X(g) + Y(g) ="==" nZ(g) +2W(g) , 5min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol.L-1.min-1. 计算:
(1)n的值为
(2)前5 min内用X表示的反应速率
(3)5 min末Y的浓度
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
(5分)向100 mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
(1)加入B溶液110 mL时,溶液中的沉淀是,溶液中的溶质是。
(2)从90 mL至100mL之间加入10mL B溶液时发生的离子反应方程式是:
Ba2+ + SO42—→BaSO4↓,Al(OH)3 + OH— →AlO2— +2H2O
溶液B中Na2SO4与NaOH的物质的量浓度之比为;
(3)计算A溶液中AlCl3的物质的量浓度,写出计算过程: