按要求从氧化铜、氯化钠、硫、氢氧化钠、硫酸、碳酸钙中选择合适的物质,将其化学式填写在下列空格中。
(1)一种非金属单质: ( 2)一种可做洗涤剂的碱:
(3)一种金属氧化物: (4)一种难溶于水的盐:
(2分)氢气燃烧能放出大量的热,而且产物是水,不污染环境,所以氢气是未来最理想的能源。请写出氢气在空气中燃烧的文字或符号表达式___________________。
我们常用实验探究的方法来研究常见物质的组成,如下图: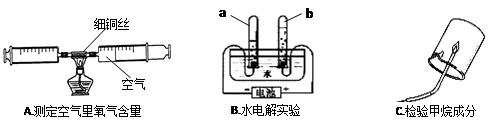
(1)A实验是利用加热铜丝消耗管内的 ____,使管内气体减少来推测空气里氧气含量的;实验过程中可观察到铜丝逐渐由红色变为色。
(2)B实验是通过电解水的反应(写出文字或符号表达式) ___,
说明水是由 _元素组成的;水电解的过程中,发生变化的微粒是 __(填名称);B实验中a试管中的气体是__________气。
(3)C实验的现象是烧杯内壁上有水雾,将烧杯倒过来加入澄清石灰水,发现石灰水变浑浊,实验现象说明甲烷燃烧后生成 ___和 _______,该实验说明甲烷中含有氢元素和碳元素;C实验证明物质组成的原理与 _______(填实验序号A或B)实验相同。
分离和提纯混合物的方法很多如:①过滤;②蒸发;③蒸馏。分离出黄泥水中的泥沙采用的是________的方法(填序号,下同);把海水中的食盐和水分离采用的是_________的方法。
完成下表:(“物质分类”一栏可填:“单质”、“化合物”或“氧化物”)
写出下列化学符号或符号的意义:
(1)氧元素;
(2)氦气;
(3) 三个钠离子;
(4)氧化镁中镁元素的化合价为+2价__________________;
(5)2H;
(6)3CO2;