在常温常压下,下列四种气态烃各1mol分别在足量氧气中燃烧,消耗氧气最多的是
| A.CH4 | B.C2H6 | C.C3H8 | D.C4H10 |
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s)D.υ(A)="0.15" mol / (L·s)
参照反应Br + H2 HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的
HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的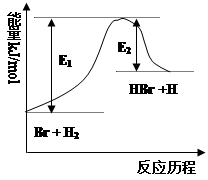
| A.正反应为放热反应 |
| B.正反应为吸热反应 |
| C.加入催化剂,活化能改变引起反应热也改变 |
| D.加入催化剂,正反应速率增大、逆反应速率减小 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
| A.C(s)+1/2O2(g)=CO(g)△H=" -393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=" -571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" +890.3" kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(g)△H=" -2800" kJ/mol |
在下列各说法中,正确的是
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
下列说法不正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.对于ΔH>0的反应,反应物的能量小于生成物的能量 |
| C.放热反应都不需要加热就能发生 |
| D.吸热反应在一定条件(如常温、加热等)下也能发生 |