用下图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
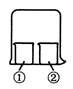
| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓盐酸 |
无明显变化 |
| B |
浓硫酸 |
浓氨水 |
冒白烟 |
| C |
酚酞溶液 |
浓氨水 |
溶液变红 |
| D |
氯化铝溶液 |
浓氨水 |
出现白色沉淀 |
相同条件下,下列有关物质性质的比较,不能用元素周期律解释的是
| A.硫酸酸性大于磷酸 |
| B.钾的金属性强于钠 |
| C.氢气燃烧生成气态水放出的热量小于液态水 |
| D.氟化氢的稳定性大于氯化氢 |
右图关于碳循环的说法不正确的是:
| A.氧元素也参与了碳循环 |
| B.绿色植物可吸收大气中CO2 |
| C.大量燃烧化石燃料会造成温室效应 |
| D.呼吸和光合作用时碳元素均被氧化 |
了解一些安全生活、生产常识,有助于自身安全及事故救助。下列有关安全处理不合理的是
| A.木材厂、纺织厂、面粉厂都必须严禁烟火 |
| B.炒菜时锅中的油着火时可立即盖上锅盖 |
| C.运输液氯的罐车泄漏时应逆风往高处跑 |
| D.化学品仓库保存的金属钠着火时可用水灭 |
下列图示的中国古代发明的制作过程涉及到化学变化的是
| A.粮食酿醋 |
B.打磨铜镜 |
C.丝线织绸 |
D.钻井取卤 |
 |
 |
 |
 |
向1 L仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示,下列说法中正确的是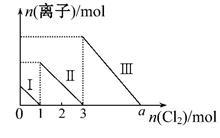
| A.线段Ⅲ表示Fe2+的变化情况 |
| B.线段Ⅰ表示Br-的变化情况 |
| C.a数值等于6 |
| D.原溶液中c(FeBr2)="4" mol·L-1 |