将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式。
| 1. |
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空: |
| 2. |
实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 |
| 3. |
将 |
| 4. |
丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。 |
工业上利用氨氧化获得的高浓度
气体(含
、
)制备
、
,工艺流程如下:
已知:
+
+
=2
+
(1)中和液所含溶质除
及少量
外,还有(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是。蒸发Ⅰ产生的蒸气中含有少量的
等有毒物质,不能直接排放,将其冷凝后用于流程中的(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀
的目的是。母液Ⅱ需回收利用,下列处理方法合理的是。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液d.转入结晶Ⅱ操作
(4)若将
、
两种产品的物质的量之比设为2:1,则生产1.38吨
时,
的理论用量为吨(假定
恰好完全反应)。
(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
研究
在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的
主要以4种无机碳形式存在,其中
占95%,写出
溶于水产生
的方程式:。
(2)在海洋循环中,通过下图所示的途径固碳。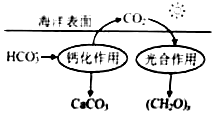
①写出钙化作用的离子方程式:。
②同位素示踪法证实光合作用释放出的
只来自于
,用
标记物质的光合作用的化学方程式如下,将其补充完整:+=
+
+
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收
,用
从酸化后的还说中吹出
并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。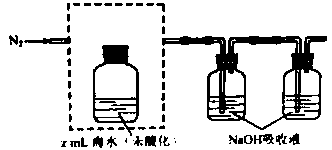
②滴定。将吸收液洗后的无机碳转化为
,再用
溶液滴定,消耗
溶液,海水中溶解无机碳的浓度=
。
(4)利用下图所示装置从海水中提取
,有利于减少环境温室气体含量。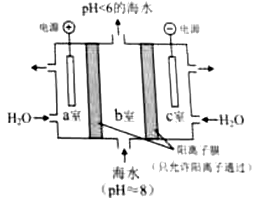
①结合方程式简述提取
的原理:。
②用该装置产生的物质处理
室排出的海水,合格后排回大海。处理至合格的方法是。
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用
进行分离。该产物的溶液在过量
的存在下会分成两层--含低浓度
的
层和高浓度的
的
层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加
前,
溶液和HI溶液不互溶
c.
在
溶液中比在
溶液中易溶
②辨别两层溶液的方法是。
③经检测,
层中
=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:
它由两步反应组成:i.
ii.
分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中
的平衡转化率随X的变化关系。
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。