| 1. |
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空: |
| 2. |
实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 |
| 3. |
将 |
| 4. |
丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。 |
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1: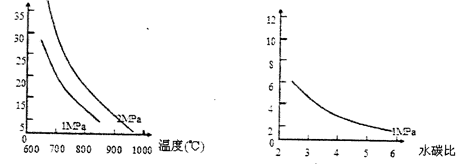
图1 (水碳比为3)图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的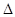 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
①写出II实验中发生反应的离子方式: 。
②根据实验发现只要有 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些____ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释: 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2C03、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4CI都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。____ 、____ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:________________。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为 mol,转移电子的物质的量为 mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):
(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g) CO2(g)+ H2(g)ΔH<0。
CO2(g)+ H2(g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。

(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1的氨水,那么该氨水的pH= 。
(已知
近年来,铝在汽车、航天、机械制造、军事等产业中应用迅猛发展。
(1)铝元素的离子结构示意图为 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式 ;在电解过程中 极(填“阴”或“阳”)需要定期补充。
(2)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性
①请写出Be(OH)2溶于NaOH溶液的化学方程式为: ;
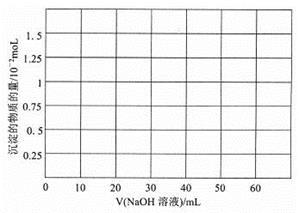
②往10.0mL1.00 mol/L的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加入量的变化图: