小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:
.出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体.
【提出问题】白色固体是什么?
【作出猜想】
猜想Ⅰ:只有
;
猜想Ⅱ:可能是
和
的混合物;
猜想Ⅲ:
【査阅资料】
(1)碳酸氢钠不稳定受热易分解
(2)
与
的热稳定性较好
(3)
和
的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想
【交流讨论】
小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行?
【继续探究】白色固体中是否有氢氧化钠?
| 实验操作 |
实验现象 |
目的/结论 |
| ①取白色固体适量配制成溶液.往所得溶液中滴加过量的 |
有白色沉淀生成 |
除去白色固体中的 |
| ②取滤液,往滤液中滴入几滴 |
|
白色固体中没有氢氧化钠 |
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意
利用如图所示的装置可进行一氧化碳还原氧化铁的实验,其中,氮气可用作本实验的保护气;盛放氧化铁的是一支带有支管的试管,其支管可用于导出试管内的气体;酒精灯带网罩;整套装置的气密性良好.实验前,弹簧夹a、b均处于关闭状态,开始实验时,打开a,通入氮气一段时间后点燃酒精灯,再关闭a,打开b.请联系所学知识回答下列问题:
(1)该实验过程中可以观察到的现象有:_________________、_________________。
(2)试管内一氧化碳与氧化铁反应的化学方程式为____________________________。
(3)实验结束时,应先打开a,再___________,然后___________,继续通氮气直至装置冷却。(选填“A”或“B”)A.熄灭酒精灯 B.关闭b
(4)待试管冷却后,把生成的黑色粉末倒在白纸上后;用磁铁靠近黑色粉末,黑色粉末全部被吸引;再取少量黑色粉末放入足量硫酸铜溶液中,搅拌后发现黑色粉末部分变红。
【提出问题】炼出来的黑色粉末的成分是什么呢?
【查阅资料】在铁的氧化物中只有氧化铁是红棕色,其余都是黑色;只有氧化亚铁在空气中会很快被氧化成氧化铁;只有四氧化三铁有磁性。
【综合探讨】同学们得出此次炼铁得到的生成物是___________________。
(5)请从两个不同角度评价该实验的优点:_______________,_________________。
.化学兴趣小组的芳芳对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。
(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。结论:石蜡的密度比水__________;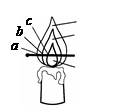
(2)点燃蜡烛,观察到火焰分为 、 、 三层。把一根火 柴梗放在火焰中(如图)约1s后取出可以看到火柴梗的 (填“a”、“b”或“c”)处最先碳化。结论:蜡烛火焰的 温度最高;
(3)芳芳在探究蜡烛燃烧的过程中,发现罩在火焰上方的烧杯内壁被熏黑,你认为她的以下做法中不合适的是()
| A.反复实验,并观察是否有相同现象 |
| B.查找资料,了解石蜡的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验目的无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色物质的原因 |
(4)再将一只干燥的烧杯罩在蜡烛火焰上方,烧杯内壁出现 ,片刻后取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡后发现 结论:蜡烛燃烧以后的生成物是 。
化学实验小组的同学们把盐酸和石灰石放入气密性良好的如图装置中,
写出反应的化学方程式(1) ,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊。针对此现象,同学们提出了自己的想法和做法,请你帮助他们完成以下探究。
【猜想与假设】 猜想一:澄清石灰水已完全变质
猜想二:气体X的成分为(2)
【表达与交流】猜想一的理由是(3)
【进行实验】 为了验证上述的猜想,同学们分别进行了实验:
甲同学实验:用一支试管另取少量原澄清石灰水,取稀硫酸与碳酸钠反应制取CO2,将产生的气体通入
所取澄清石灰水中,石灰水变白色浑浊。
得出结论:猜想一不成立。
乙同学实验:用一支试管另取少量紫色石蕊溶液,将气体X通入紫色石蕊溶液中,紫色石蕊溶液变成红色。
得出结论:猜想二成立。
丙同学实验:用一支试管另取少量硝酸银溶液,将气体X通入硝酸银溶液中,出现白色沉淀。
得出结论:猜想二成立。
【反思与评价】同学们讨论后认为,(4) 同学的实验不能得出正确结论,理由是(5) 。
(6)丙实验中出现白色沉淀的化学反应方程式为 。
某同学设计了测定空气中氧气含量的实验,实验装置如右图。该同学的实验步骤如下: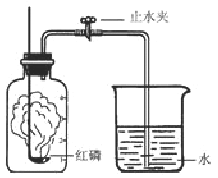
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷需稍过量,目的是 ;
(2)步骤③中打开止水夹后观察到的现象是_____________________________;
由本实验还可推知氮气的哪些性质?试写出一种: 。
(3)若将红磷换成木炭,该实验能否获得成功_____________(填“能”或“否”)?理由是 。
实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结
合图示回答有关问题。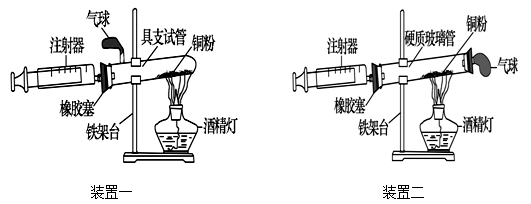
(1)根据下表提供的实验数据,完成下表
| 具支试管或硬质玻璃管中空气的体积 |
反应前注射器中空气体积 |
反应后注射器中气体体积 |
实验测得空气中氧气的体积分数 |
| 25mL |
15mL |
9mL |
(2)装置一和装置二中气球的位置不同, (填“装置一”或“装置二”)更合理,理由是 。
(3)若实验测得结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举一条) 。