某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式: 。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜 想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三: 。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象: 结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象: 结论:猜想二不正确,猜想三正确
【反思与拓展】(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)
| A.pH试纸 | B.铜 | C.紫色石蕊溶液 | D.硝酸银溶液 |
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是 (写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题。某化学研究小组的同学对某种塑料袋的组成进行分析研究(资料显示该塑料只含C、H两种元素)。他们设计了图18所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请指出错误处,并写出(或在答题卷上画出正确图并用字母标注上哪一个装置)改正方法
(2) 装置F的作用是.
(3) 若装置C的玻璃管中放入的塑料试样质量为5.9g,塑料试样充分燃烧后,装置D增重7.2g,则该塑料试样中含氢元素的质量为g;假设塑料的组成为CxHy,则装置C的玻璃管中反应的化学方程式为(化学计量数用含x、y的代数式表示,且可以是分数)
(4)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果( 填“偏小”、“ 偏大”或“无影响” )
.绿色植物的呼吸作用会产生二氧化碳,小明猜想:种子的萌发过程可能也会产生二氧化碳,他设计了如图实验装置。打开D装置中的阀门,水位下降,空气就会依次进入装置。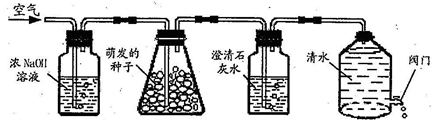
ABC D
(1)按照实验设计意图,如果观察到C装置中澄清石灰水变浑浊现象,则小明的猜想是正确的。但思维严密的小庭却认为实验还有漏洞,她建议在(选填:AB、BC或CD)之间再增加一个C装置,就可以弥补上图实验设计的不足,那么,改进后的实验装置中,当观察到现象时才能证明小明的猜想是正确的。
(2)请指出D装置的一个优点:。
请参与某学习小组进行研究性学习的过程,并协助完成相关任务:
[提出问题] 在平时探讨酸的性质时,我们通常是讨论酸的水溶液。究竟水在酸显示酸的特性时扮演什么角色呢?
[确定研究对象] 以我们最熟知的盐酸(氯化氢的水溶液)和氯化氢进行探究。[查阅资料] 氯化氢溶于水时解离出氢离子和氯离子,而溶于干燥的甲苯(一种有机溶剂)时仍以氯化氢分子的形式分散(如下图)。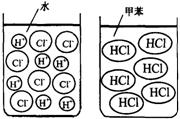
[设计与实验] (请完成下表)
| 实验内容 |
实验现象 |
解释与结论 |
| 测定导电性 |
氯化氢的水溶液:导电性良好 |
氯化氢的水溶液中有自由移动的离子 |
| 氯化氢的的甲苯溶液:A |
氯化氢的甲苯溶液中没有自由移动的离子 |
|
| 与镁作用 |
氯化氢的水溶液: B |
化学方程式: C |
| 氯化氢的甲苯溶液:没有明显的现象 |
氯化氢在甲苯溶液中没有解离出氢离子 |
|
| 与固体碳酸钠的作用 |
氯化氢的水溶液:产生气泡 |
化学方程式: D |
| 氯化氢的甲苯溶液: |
氯化氢在甲苯中没有解离出氢离子 |
[讨论与反思] 盐酸的酸性是因为氯化氢在水分子的作用下解离出了_______________E____。
小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
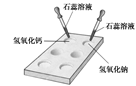
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 |
氢氧化钙溶液 |
|
| 加紫色石蕊溶液 |
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式。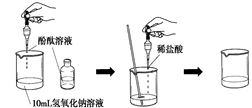
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式。
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成
为止。
这一实验说明:酸与碱作用生成了盐和水,这一反应叫做反应。中和反应的实质是;实验中滴加酚酞的作用是。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
①②
化学兴趣小组同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这半瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为①氢氧化钙;②氢氧化钙、碳酸钙;③。
(3)设计方案、进行实验:请你参与探究,并填写下表。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取样品少量于小烧杯中,加入适量水,充分搅拌,过滤。 |
||
| ②。 |
大量气泡 产生 |
氢氧化钙已经变质。 |
| ③取少量滤液于试管中,。 |
氢氧化钙没有完全变质。 该反应的化学方程式为。 |
(4)联想与启示:氢氧化钙变质是由于它与空气中的发生化学反应的缘故,因此氢氧化钙应保存。