X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略)。下列组合中不符合该关系的是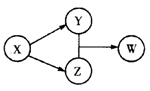
| |
A |
B |
C |
D |
| X |
HCl |
Na2O2 |
Na2CO3 |
SO2 |
| Y |
FeCl2 |
NaOH |
CO2 |
Na2SO3 |
| Z |
Cl2 |
Na2CO3 |
CaCO3 |
H2SO4 |
| W |
FeCl3 |
NaHCO3 |
Ca(HCO3)2 |
NaHSO3 |
室温时,在容积为amL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLO2,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不能支持燃烧。则a、b、c的关系是 ( )
| A.a=4b+3c | B.a=4b+c | C.a:b=4:1 | D.a:b=4:3 |
11.9gMg、Al、Fe组成的合金溶解于足量的NaOH溶液,合金质量减少2.7g,另取等质量的合金溶解于足量的硝酸中,反应后产生标准状况下的6.72LNO,向所得溶液中加入适量的NaOH溶液恰好使金属离子转化为沉淀,则沉淀为()g
| A.22.1 | B.27.2 | C.30 | D.14.6 |
下列实验过程中的有关变化与对应的图形相符合的是
向一定量的CuSO4溶液中加入一定量的铁粉充分反应,可能出现的情况是
①溶液中的金属离子有Fe2+、Cu2+,不溶物是Cu
②溶液中的金属离子有Fe2+、Cu2+,不溶物是Fe
③溶液中的金属离子只有Cu2+,不溶物是Fe
④溶液中的金属离子只有Fe2+,不溶物是Fe、Cu
| A.①③ | B.①④ | C.②③ | D.③④ |
同温同压下,两个等体积的干燥烧瓶中分别充满①NH3、②NO2,进行喷泉实验,如图所示。经充分反应后,瓶内溶液的物质的量浓度
| A.①>② | B.①<② | C.①=② | D.不能确定 |