1-36号A、B、C、D、E 、F六种元素,其中A、B、C、D、E的原子序数均小于18且其核电荷数依次递增,B元素基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,D原子的价电子排布为ns2np2n+2, E原子第一至第四电离能(kJ·mol-1)分别为:738、1451、7733、10540。F2+离子K、L、M层全充满。根据以上信息,同答下列问题:
(1)BA4D和BA2D,沸点较高的是 (填相关物质的结构简式)
(2)已知B与A形成的化合物在标准状况下的密度为1.16g·L-1,则在该化合物分子空间构型 ,在该化合物分子中含有σ键和π键个数比 。
(3)写出单质F与足量C的最高价氧化物对应的水化物稀溶液反应,C被还原到最低价,该反应的化学方程式 。
(4)下图能正确表示第三周期部分元素的第二电离能(I2)与原子序数关系 (填标号)。
(5)B的单质是一种层状结构,元素B和E的形成一种合金,E的原子位于B的层间,其投影位于层面六圆环的中央,“△”表示E的原子位置,平行四边形表示在此二维图形上画出的一个晶胞,该合金的化学式为________。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]--、MnO4—、CO32--、SO42—中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)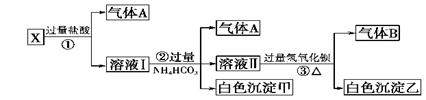
(1)气体A的成分是:_________________,气体B的成分是_____________
(2)X溶液中一定存在的离子是:____________________________
(3)写出步骤①发生反应的所有离子反应方程式:_________________________
(4)写出步骤②形成白色沉淀甲的离子方程式:______________________
(5)写出白色沉淀乙的可能组成:____________________________
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为________。
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:_______。
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_________。
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:请回答下列问题: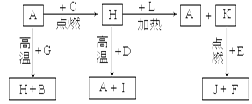
(1)元素A在元素周期表中的位置为周期族。
(2)写出K的电子式。
(3)写出H和D反应的化学方程式。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式。
(5)写出A与G反应的化学方程式。
(6)K与E反应时产生的现象有;该反应的化学方程式为 ______________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式__________。
(11)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)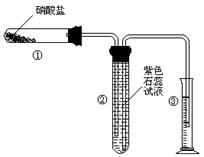
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式:、。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式:;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3  2Ag2O+4NO2↑+O2↑,(Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑,(Ⅱ)2AgNO3  2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是,并说明理由:。
请你设计一个简单的实验证明你的结论是正确的:。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律:。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
(1)某烷烃A,其蒸气密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
①若A不是烯烃与氢气加成的产物,则A的结构简式为:;
②若A是炔烃与氢气加成的产物,则A的名称为:。
(2)某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2、H2O各1.2 mol。试回答下列问题:
③若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为。
④若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,则烃A可能的结构简式有 _______种。其中和HBr加成产物只有一种的是_______________(写出结构简式)