在100 mL某混合酸中,c(HNO3)=0.4 mol·L-1,c(H2SO4)=0.1 mol·L-1,向其中加入1.92 g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
| A.0.15 mol·L-1 | B.0.30 mol·L-1 | C.0.225 mol·L-1 | D.无法计算 |
NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是()
| A.NH3·D2O和HD2O+ |
| B.NH3·HDO和D3O+ |
| C.NH2D·D2O和DH2O+ |
| D.NH2D·HDO和D3O+ |
下列各组物质的物质的量浓度和体积相同,混合后pH大于7的是()
| A.BaCl2、NaNO3、NH4Cl | B.K2CO3、HCl、CaCl2 |
| C.Na2CO3、HNO3、HCl | D.K2S、KCl、HCl |
有3种物质的量浓度相同的盐溶液:NaX、NaY、NaZ,其溶液的pH按NaX\,NaY\,NaZ的顺序依次增大,则知3种酸HX、HY、HZ的强弱顺序应是()
| A.HX>HY>HZ | B.HX<HY<HZ |
| C.HX>HZ>HY | D.HX<HZ<HY |
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合液,其中c(CH3COO-)大于c(Na+),该混合物溶液的下列判断正确的是()
| A.c(H+)>c(OH-) |
| B.c(CH3COOH)+c(CH3COO-)=0.2mol·L-1 |
| C.c(CH3COOH)>c(CH3CO1O-) |
| D.c(CH3COO-)+c(OH-)=0.1mol·L-1 |
已知在Na2HPO4溶于水后,它的水解程度远大于电离程度。对于平衡: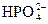 +H2O
+H2O H3O++
H3O++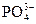 ,欲使溶液中c(
,欲使溶液中c(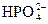 )、c(H3O+)、c(
)、c(H3O+)、c(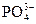 )均下降,可采用的方法是()
)均下降,可采用的方法是()
| A.加少量水 | B.加热 |
| C.加消石灰 | D.加AgNO3 |