短周期元素X、Y、Z、W 的原子序数依次增大, X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.X、Y、Z、W 原子最外层电子数之和为13。问:
(1)X是 Y是 Z是 W是 (填元素符号)
(2)写出W的最高价氧化物对应的水化物的电子式
写出Y的简单氢化物的电子式
(3)Y的最高价氧化物对应的水化物的浓溶液久置后呈现黄色,写出发生反应的化学方程式
(4)实验室制取Y的氢化物的化学方程式:_______________________________,该反应________(填“是”或“不是”)氧化还原反应。
(14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(2)某同学根据上述信息,所画的B电子排布图如图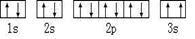 ,违背了原理。
,违背了原理。
(3)F位于族区,其基态原子有种运动状态。
(4)CD3 中心原子的杂化方式为,用价层电子对互斥理论推测其分子空间构型为,检验E元素的方法是。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
(10分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号)。其原因是。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。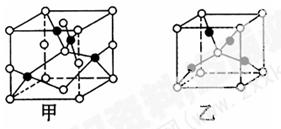
(8分)氮及其化合物在生产、生活和科技等方面有着重要的应用。请回答下列问题。
(1)氮原子的原子结构示意图为________________________________。
(2)氮气的电子式为________,在氮气分子中,氮原子之间存在着________个σ键和________个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能________磷原子的第一电离能;
②N2分子中N—N键的键长________白磷分子中P—P键的键长。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是__________________。
(8分)元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式__________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物中最不稳定的是________(填化学式)。
(3) A、B、C的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的结构式为________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
(每空1分,共10分)根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号__________。
(2)最外层电子排布为4s24p1的原子的核电荷数为__________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为:,SO2的立体结构为:。
(5)周期表中最活泼的非金属元素原子的轨道表示式为__________。
( 6 ) 三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
( 7 ) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是__________。
( 8 )写出铬元素在周期表中的位置__________,它位于__________区。