燃烧11.2L(标准状况)甲烷,生成二氧化碳和水的物质的量各是多少?
(1)钾玻璃中含有18.4%的K2O,11.0%的CaO和70.6%的SiO2,试计算这三种氧化物的物质的量之比。
(2)若需制造5.10 t钾玻璃,需用K2CO3、CaCO3和SiO2各多少吨?
(3)写出制钾玻璃的化学方程式及钾玻璃的主要成分。
自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为:aCuCO3·bCu(OH)2(a、b为正整数,且a≤2,b≤2)。
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:孔雀石为4∶1;石青为3∶1。则它们的化学组成为:
孔雀石:_________,石青:_________。
(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO2 3.36 L(标准状况),加热B样品,使其完全分解,得到20 g CuO。试计算并确定该矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO2 6.72 L(标准状况),这份矿样中CuO含量不低于_________g。
(4)设某碳酸盐类铜矿样的质量为A g,所含CuO质量为G g,加酸完全溶解后,产生的CO2的体积(标准状况)为V L,则含铜矿样的A、V、G之间的关系式为:_________。
环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
①将2.000 L的气体样品通过盛有I2O5固体的加热管,发生的反应为
5CO+I2O5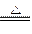 5CO2+I2
5CO2+I2
②将所产生的碘升华,并加入30.00 mL 0.005 0 mol·L-1的硫代硫酸钠溶液,发生的反应为
I2+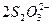 ====2I-+
====2I-+
③将②中溶液取出,加入1.000 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1 L该气体样品中有多少毫克(mg)的CO。
由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,当铜片上放出3.36 L(标准状况)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少个电子通过了导线?
(3)200 mL稀H2SO4的物质的量浓度是多少?
一定质量由铝粉和四氧化三铁组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细并分成两等份,分别投入过量的烧碱溶液和盐酸中,充分反应后,前者消耗m mol NaOH,放出0.336 L气体;后者消耗n mol HCl,放出V L气体。若将等质量的这种铝热剂中铝粉与足量的稀硫酸反应,可得到3.36 L气体(气体体积均在标准状况下测定)。求:
(1)该铝热剂组成成分的质量分数。
(2)m、n、V的值。