碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为 ,可能发生副反应有 。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为 。
(3)向75 mL 4 mol•L-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。①写出该反应的离子方程式: 。(只用一个离子方程式表示)
②该吸收溶液中离子浓度大小排序为 。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=—571.6kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = —90.8kJ•mol-1
CH3OH(g) △H3 = —90.8kJ•mol-1
计算甲醇蒸气的燃烧热 = 。
= 。
(5)某温度下,发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 
①向某容器中充入1.0 molH2和1.0 molCO2(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
| |
0 |
5 min |
10 min |
15 min |
20 min |
25 min |
| I(800℃) |
1.0 |
0.80 |
0.70 |
0.65 |
0.50 |
0.50 |
| II(800℃) |
1.0 |
0.7 |
0.60 |
0.50 |
0.50 |
0.50 |
相对实验I,实验II可能改变的条件可能是 ,该温度下,平衡常数= 。
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应。
下列图像正确且说明可逆反应达到平衡状态的是 。(填序号)
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接: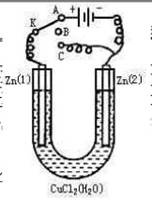
(1)如果把开关K接A,该装置应是,Zn(2)极是极,电极反应式为。
(2)上述反应进行5min后,置换开关K到C,则该装置是,Zn(2)极是极,电极反应式是。
(3)上述装置进行2min后,再置换开关K至B,则Zn(1)极发生的化学反应方程式为,Zn(2)极发生的有关电化学的反应方程式为。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):请填写下列空白: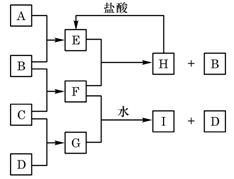
(1)A是,C是。
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液反应生成I和D的离子方程式是。
将32g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
NO的体积为 L,NO2的体积为 L。
待产生气体全部释放后,溶液中加500mL 4mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH不可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)
下图中每一方框代表一种反应物或生成物: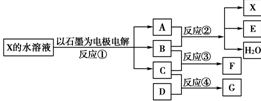
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
| C |
D |
G |
|
| 起始 |
3 mol |
1 mol |
0 |
| 3 min时 |
2.4 mol |
0.8 mol |
0.4 mol |
①写出反应②的离子方程式___________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。