下列实验操作中正确的是( )
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处, 且冷却水从冷凝管的上口通入下口流出 |
| D.向氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2 + CO2 + 2H2O=Al(OH)3↓ + NaHCO3 |
将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。有关说法不正确的是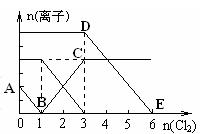
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)= 6 mol/L |
| C.当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
| D.原溶液中n (Fe2+): n (I-): n(Br-)=2:1:3 |
下列离子方程式正确的是:
| A.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑ |
| B.向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀: 2Al3+ + 6OH- +3SO42- +3Ba2+ = 2Al(OH)3↓+ 3BaSO4↓ |
| C.在2mol/L FeBr2溶液80mL中通入4.48L氯气(标况下),充分反应: 4Fe2+ +6Br- +5Cl2 = 4Fe3+ + 3Br2 + 10Cl- |
| D.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+==H2↑+ Cl2↑ |
下列各条件下可能共存的离子组是
| A.某无色溶液中:NH4+、Na+、Cl-、MnO4- |
| B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32- |
| C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |