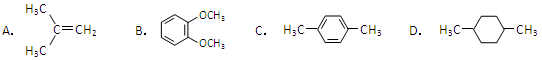现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑ ②H++CO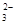 ===HCO
===HCO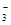 ③CO2+H2O+ClO-===HClO+HCO
③CO2+H2O+ClO-===HClO+HCO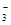 ④CO
④CO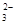 +HSO
+HSO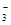 ===HCO
===HCO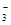 +SO
+SO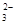 ,由此得出的如下结论中不正确的是
,由此得出的如下结论中不正确的是
A.CO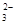 与H+、Ca2+不能大量共存 与H+、Ca2+不能大量共存 |
B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 | D.H2CO3、HClO都属于弱酸 |
下列有关实验的叙述中,不正确的有( )
①蒸干AlCl3溶液可得纯净的无水氯化铝
②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
③无法用分液漏斗将甘油和水的混合液分离
④可用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测液中,片刻后取出,与标准比色卡进行对比
⑥苯与溴水在铁粉催化作用下制备溴苯
⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,至产生的沉淀刚好溶解为止
⑧在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀
| A.4句 | B.5句 | C.6句 | D.7句 |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①用pH试纸检验,溶液的pH>7
②取少量原溶液,加入过量的BaCl2和盐酸的混合溶液,无白色沉淀产生
③另取少量原溶液,加入足量的氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分离
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入的AgNO3和HNO3的混合溶液有白色沉淀产生
则关于原溶液的判断中不正确的是( )
| A.肯定不存在的离子是Fe3+、NH4+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
最新研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气:
①MnFe2O4(s)=MnFe2O(4-x)(s)+x/2 O2(g);△H1
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g);△H2下列说法错误的是( )
| A.反应①中O2是氧化产物,反应②中水是氧化剂 |
| B.该热化学循环制氢过程简单、无污染,物料可循环使用,安全易分离 |
| C.若MnFe2O(4-x)(s)中x=0.8,则MnFe2O(4-x)(s)中Fe2+占全部铁元素的百分率为60% |
| D.若xH2(g)+x/2O2 (g)=xH2O(g);△H3,则△H3=-(△H1+△H2) |
Fe3+、Fe2+、NH4+、H+、H2O、NO3-六种粒子,它们都是同一氧化还原反应中的反应物或生成物。下列叙述中不正确的是( )
| A.该反应中氧化剂与还原剂的物质的量之比为1∶8 |
| B.若有1mol NO3-发生还原反应,转移的电子数为8mol |
| C.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| D.若把该反应设计成原电池,负极的反应为Fe2+-e-=Fe3+ |
在核磁共振氢谱中出现两组峰(表示有不同的氢),其氢原子数之比为3∶2的化合物是( )