氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应
Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41 g |
用NA表示阿伏加德常数的值,下列说法正确的是
| A.1molNaHSO4晶体中含有的离子总数为3NA |
| B.12.4g白磷(分子式为P4)中含有的P—P键为0.6 NA |
| C.28g C2H4和C4 H 8混合气体中含有的原子总数为9NA |
| D.200mL 10mol/L的浓硝酸与足量的铜片反应,生成的NO2分子数目为NA |
下列实验装置(固定装置略去)和操作正确的是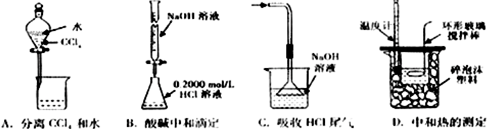
下列有关日常生活中涉及到的化学知识的描述不正确的是
| A.用煮面汤洗涤餐具上的油污 |
| B.用碘水检测土豆中含有淀粉 |
| C.用料酒清洗热水瓶中的水垢 |
| D.利用丁达尔效应区别鸡蛋清和食盐水 |
下列操作容易造成蔬菜中的维生素损失的是()
| A.洗菜:要先洗后切 |
| B.浸泡:切好的菜要浸泡半天,以除去残留农药 |
| C.切菜:要随切随炒,切忌切好后久置 |
| D.烹饪:烹调蔬菜时适当加点醋,可以减少维生素C的损失 |
在入住装修过的新房前,下列做法中错误的是()
A. 装修新房季节最好选择夏季
B.适度开窗通风,充分地进行内外空气对流
C.用高浓度的甲醛对室内环境消毒
D 在各个房间内均匀的放置适量的吊兰.芦荟等鲜花