(10分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。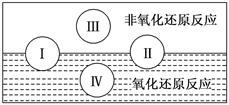
试写出有参水加的符合反应类型Ⅳ的一个化学方程式:
________________________________________________________,其中水为________剂。
(3)氯化铵常用作焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ 个电子转移。
(5分)下列各组物质① O2和O3②乙烷和丁烷
③12C和14C④ CH3CH2CH2CH3和 (CH3)2CHCH3
⑤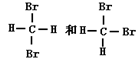
互为同系物的是_______,互为同分异构体的是______
互为同位素的是______,互为同素异形体的是______,
是同一物质的是______。(请填写序号)
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色物质是(填化学式)。
(2)刺激性气味的气体主要成分是(填化学式),产生该气体的化学方程式为。
(3)根据上述实验现象,表明浓硫酸具有(填序号)。
①酸性②吸水性③脱水性④强氧化性
钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的(填“强”或“弱”);常温下,可用(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为;可观察到的实验现象是(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为。
Fe跟Cl2在一定条件下反应,所得产物的化学式是。将该产物溶于水配成溶液,分装在两支试管中。请回答:
(1)若向其中一支试管中滴加KSCN溶液,则溶液变成色。
(2)向另一支试管中滴加NaOH溶液,现象为,产物的化学式是______________。
现有下列四种物质:① SO2、② NO、③ Na2SO4溶液、④ AlCl3溶液。其中,遇空气变为红棕色的是(填序号,下同),能使品红溶液褪色的是,加入氯化钡溶液产生白色沉淀的是,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是。