(8分)将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。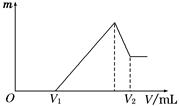
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
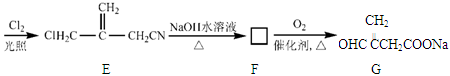
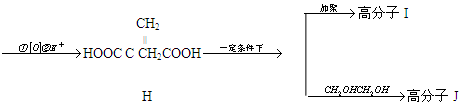
衣康酸H是制备高效除臭剂,粘合剂等多种精细化工的重要原料,可经下列反应路线得到(部分反应条件略)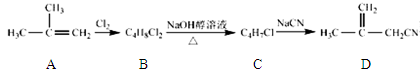
已知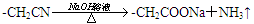
(1) C→D的反应类型是,B→C所加的试剂是,H→I发生反应的官能团的名称叫
(2) J的结构简式为
(3) H不能发生的化学反应是(选填序号)
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(4) E→F反应的化学方程式
(5) H的同分异物体M具有如下的性质:①M不能使溴的CCl4溶液褪色;②1 molM 最多可以与2mol NaOH反应;③1 mol M与足量的NaHCO3反应可生成1mol CO2,则M的结构简式为(写出一种)
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是(选填序号)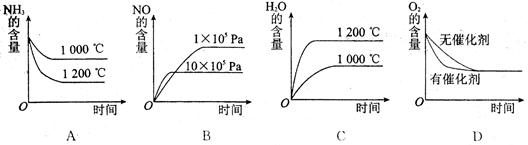
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第2min |
3.2 |
x |
0.8 |
1.2 |
| 第4min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g)ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g)ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g)ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g)ΔH=kJ/mol (用a.b.c表示)
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
(1)步骤①中废渣的主要成分是,③中X试剂为。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □+□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为。
(6)该工艺流程中,可以循环利用的物质有。
含苯环的化合物A有C、H、O、Br四种元素组成,分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。有关A的变化关系如下图,其中C能使FeCl3溶液显紫色,H、I、K都能发生银镜反应。请回答下列问题: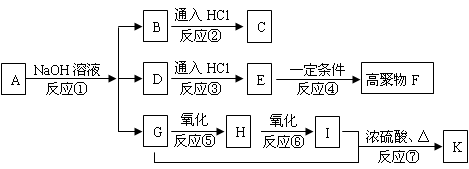

(1)A中含有官能团的名称是,A的核磁共振氢谱有个吸收峰,1 mol A可以与mol NaOH反应。
(2)关于C 的说法正确的是(填标号)。
A.常温下,能与溴水发生加成反应
B.可以与酸性高锰酸钾溶液反应
C.一定条件下能发生消去反应
D.苯环上一氯取代产物共有3种
(3)写出反应④的类型:,F的结构简式:。
(4)请写出G+I→K的反应方程式。